 |
| �@ �g�b�v�y�[�W > �E�ʊ����܂ɂ�閌�^���p�N�� X �������\���̕���\���� |
 |
||||||||||||||
�A��
| ||||||||||||||
|
�R�@�_ ����w��w�@��w������ |
1�D �͂��߂�
�@�� 1 ��̖{�A�ځiNo.152�j�ł́A�s�R�o�C�I���W�[�̊T�O�ƌ���ɂ��āA�E�V�S�`�g�N�����_���y�f�iCytochrome c Oxidase�A�ȉ� CcO �j�̌�����������グ�ĊT�������B CcO �́A�~�g�R���h���A�����Ɉʒu���ċz�������̂̈�ōזE�ċz�̖��[�_���y�f�Ƃ��ċ@�\�����q��_�f�𐅂ɂ܂ŊҌ�����ƂƂ��ɁA�v���g��������̓�������O���ɔ\���A������B���� 2 �̔����ɂ�萶�����v���g���Z�x���z�� ATP �����y�f�ɂ�� ATP �����ɗ��p�����B�E�V�S�� CcO �� 13 ��ނ̈قȂ�T�u���j�b�g����Ȃ镪�q�� 20 ���̖��^���p�N�������̂ł���B���̍y�f�̕��q��_�f�Ҍ��@�\�A�d�q�ړ������ƃv���g���A�������̋����@�\���𖾂��邽�߂ɂ́A�U�������@�ɂ���Ă����炳���s�R���[�g���i10-12 m�j�̐��x�ł̉��w���������� X �������\����͖@�ɂ���Ă����炳���S���q�̋�ԓI�ʒu���̗Z�������߂���B ����ɂ�薾�炩�ɂȂ�Ɗ��҂����u�����̉��w�̌��t�����ł͐����ł��Ȃ��������ۂƂ̏o��v�̂��߂ɂ́A���^���p�N���̍�����\ X �������\���͕s���ł���B�����ŁA�� 2 ��̘A�ڂł̓s�R�o�C�I���W�[�̒��j��S�����^���p�N���� X �������\����͂ɂ����Ď�v�Ȉ��q�̈�ł���E�ʊ����܂ɂ��Ċ�b�I�ȊT�����q�ׂ��B�ŏI��̖{�A�ڂł́A�E�V�S�� CcO �� X �������\���̕���\����ɊE�ʊ����܂̑I���������ɏd�v�ł����������l�@����B
2. �@�E�V�S�� CcO �_���y�f�̐����A�������ɂ�����E�ʊ�����
2.1.�@�E�V�S�� CcO �̑I��
�@�_�f�ċz���s���قƂ�ǂ̐����� CcO �������Ă���A���݂܂łɐ��\��̐����킩��P���E���肳��Ă���B�����킪�ς���Ă��G�}���锽����_���Ҍ�������S���������S�̍\�����قƂ�Nj��ʂł��邪�A�T�u���j�b�g�g���͚M�������� 13 ����ۂ� 2 �܂ő傫���قȂ� 1) �B��X�́A����琶����̒�����E�V�S�� CcO �� X �������\����͂̍ޗ��Ƃ��đI�������B���̑� 1 �̗��R�́A�����Ȋw�̖ڕW�̈�̓q�g�𗝉����邱�Ƃɂ���B���̂��߁A�q�g�Ɠ����T�u���j�b�g�g���ʼn䂪���ŐV�N�ȍޗ��̋����̍ł��e�ՂȚM�������̑g�D�Ƃ��ăE�V�S��I�������B�� 2 �̗��R�́A�} 1 �Ɏ������悤�ɊE�ʊ����܂ɉn�����ꂽ���^���p�N���ł́A�E�ʊ����܂��������Ă��Ȃ��e�����̈�̑��ݍ�p�Ō������`�����邽�߁A�傫�Ȑe�����̈�����E�V�S�� CcO �̕����L���Ȃ��߂ł���B�������ɔ��\���ꂽ�� CcO �ł͍R�̂����������邱�ƂŐe�����̈�̊g���}���Ă���A���ł͖��^���p�N���������̏�@�� 1 �ƂȂ��Ă��� 2) �B

2.2.�@�E�V�S�� CcO �̐���
�@���^���p�N���̐����̈�ʓI�ȕ��@�͂܂��Ȃ��A���^���p�N���̎�ނ��Ⴄ�ƕʐ��E�Ƃ�����قǏ������قȂ�B����ł��A���閌�^���p�N���̐����̂Ƃ����ӂ��Ȃ���Ȃ�Ȃ��������Ƃ����̖��^���p�N���ɂ��K�v�ł��邱�Ƃ������Ǝv����B�ȉ��ɉ�X���s���Ă���E�V�S�� CcO �̐����̎菇���L�q����B
2.2.1. �R�[���_�i�g���E���ɂ��~�g�R���h���A��������� CcO �̉n���@
�@�E�V�S�� 800 g ����~�g�R���h���A�����悵�A�R�[���_�i�g���E���Ɨ��_�A�����j�E���ɂ�� CcO ���n������B���ɃR�[���_�i�g���E���Z�x�͂ɂ���Ēቺ������Ƒ啔���̃`�g�N���� bc 1 �����̂�n���^���p�N�����������邱�Ƃ��ł���B �c�]�̕s���^���p�N���̓R�[���_���݉��ŗ��_�A�����j�E������ɂ�菜������B�C�I�����E�ʊ����܂ł���R�[���_��p�������̕��@�� 1941 �N�ɊJ�����ꂽ���̂ł��邪�A���ł��ł��L���ȃ~�g�R���h���A��������̉n���@�ł��� 3) �B
2.2.2. ��C�I�����E�ʊ����܂ɂ��n��
�@�����̏����t�Ɋ܂܂�Ă���R�[���_��f�I�L�V�R�[���_�́A���ɓ����g�D�̖��^���p�N���̉n���ɂ͗L���ł��邱�Ƃ������B����A�y�f�̊�����j�Q������A�ϐ��������N�����\��������B�����ŁA��C�I�����E�ʊ����܂̑��݉��ŗ��_�A�����j�E��������J��Ԃ��R�[���_�i�g���E���ƌ�������ƂƂ��ɁA����ɏ�����i�߂�B���̂悤�ɂ��ē���ꂽ�W�i�����O��ߖ��ŔZ�k����ƁA�����������̒��a�킸�ɐ�����B���������ɂ���āA���_�A�����j�E������ł͏����ł��Ȃ����ʂ̕s���^���p�N������菜�����Ƃ��ł���B���̕��@�� 4 ���Ԃ� 0.5 g �̔������W�i�邱�Ƃ��ł��� 4)�B
2.2.3.�@��C�I���E�ʊ����܂̎��
�@
�E�V�S�� CcO �̌������ł́A�O���̔�C�I�����E�ʊ����܂̎�ނ�������\ X �������\����͂̎����ɍł��d�v�ł������B�ȉ��ɂ��̊T���������B
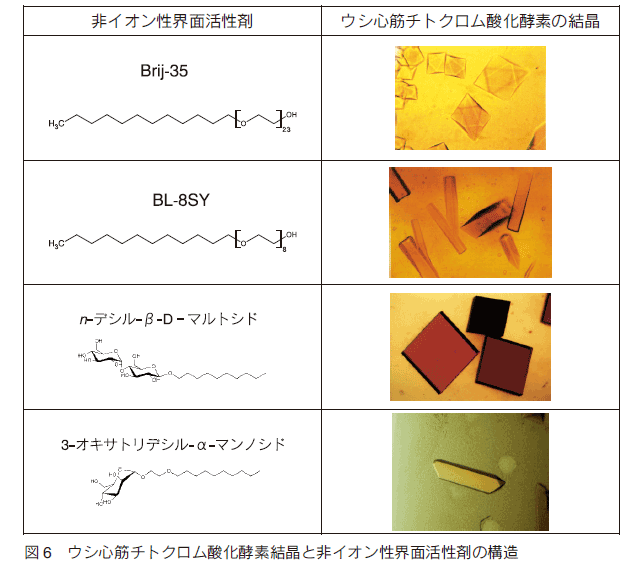
�@�����́A��C�I�����E�ʊ����܂Ƃ��ă|���I�L�V�G�`�����A���L���G�[�e���iAE�j��I�������B�܂��ABrij-35�iC12E23�j��p���邱�ƂŘZ�����n�̌������쐻���A���������̖��^���p�N���̌����Ƃ��ď��̉�ܑ��� 5)�B�������A X ���ɂ�镪��\�� 8���ł��茴�q���x���ł̍\����͂ɂ͂�������Ă����B����ɁA�����͎����ł� X ����������ʏ�ł��������A�K���X�L���s�����[�ɕ����͂ł�����̂̉�ܔ\������������������p�x�����Ȃ��Ƃ�����肪�������BBrij-35 �͑a�����ł���A���L����̒Y�f���� 12 �ł��邪�A�e�����̈�̃I�L�V�G�`�������̐��� 23±n �ł���ψ�ł͂Ȃ��B���̐e�����̈�̑����U���Ⓑ���́A�������`������e�����̈�̕��q�ԑ��ݍ�p��s���艻����ƍl����ꂽ�B�����ŃA���L����̒Y�f���� 12 �̂܂܂ŁA�I�L�V�G�`�������̒����� 8 �̃I�N�^�G�`�����O���R�[�����m�h�f�V���G�[�e���iBL-8SY�j��p���Ĕ������W�i���쐻���A���_�A�����j�E������𒾓a�܂Ƃ��Č����������Ƃ��� 5�� ����\�̉�ܑ���^���A�����I�Ռ��ɂ�����Ȍ���������ꂽ 6)�B���̌�̌����̌��ʁA�Y�f�� 10 �̃A���L����ƃ}���g�[�X�� β-�O���R�V�h�������� n-�f�V��-β-D-�}���g�V�h���iβ-DM�j�p���邱�Ƃ� 2.8�� ����\�� X �������\����͂ɐ������� 7) ,8)�B���̏ꍇ�A�������̒��a�܂Ƀ|���G�`�����O���R�[���iPEG�j4000 ��p���Ă���E�ʊ����܂̍\���ω��ɉ����Č����������̍œK����}�����B
3�D X ������������̌����ɂ�镪��\�̌���
�@��q�� 2.8��\�� X �������\���́A���Ύs�̃t�H�g���t�@�N�g���[�ɂăr�[�����C���̎����n�b�`�S�̂�� 10�� �ɐݒ肵������ɂ���ē���ꂽ�B���ɕ����̌����𗘗p���邱�Ƃ� X ���̘I�����Ԃ������� 2.3�� ����\�̍\�������肵�� 9)�B���̌�A��O������ˌ��{�݁iSPring-8�j�ł̎������\�ƂȂ������߁A����ɕ���\���オ���҂��ꂽ�B�������A���������ɂ����ː�������ቺ�����邽�� 100 K �t�߂ł̒ቷ����͕K�{�ł���B ���̂��߂ɂ́A�����̗n�}���O���Z���[���Ȃǂ̃N���C�I�v���e�N�^���g�ɒu������K�v������B��X�́A�S���̒Ⴂ�G�`�����O���R�[���������̓v���s�����O���R�[����I�������B CcO �����̏ꍇ�A������\�f�[�^���W�ɂ͍ő�ӂ� 1 mm ���x�̑傫���̌������K�v�ƂȂ�B�܂��������ł͕��q�� 20 ���̕��q�������������E�ʊ����܂ɕ����Ďc��̐e���������̑��ݍ�p�݂̂Ō����\�����ێ����Ă���B���̂��߁A�}���ȗn�}�����̕ω��͌����ڂł����炩�ȑ�����^����B 35�� �̃N���C�I�v���e�N�^���g���K�v�ł��邪�A�����ڂ��̗n�t�ɐZ��������ƒ����Ɍ����͉���B�����ŁA1���A3���A5���A10���A15���A20���A25���A30�� �̃N���C�I�v���e�N�^���g�n�t���������� 30 ���ȏ㎞�Ԃ������Ă���Z�x���グ�Ă������@���̗p�����B�܂��������t�̒��f�ɒ��ړ���������@�� 100 K �̒��f�C�����ōŏ��ɓ��������Ă���t�̒��f�ɕۑ�������@�����邪�A�����̓��^�����ێ�����ɂ͌�҂̕��@���K���Ă����B���̂悤�ɂ��āA�ቷ������ SPring-8 �̑���w�`�����������r�[�����C���iBL44XU�j�ɉ����� X ����܃f�[�^�����W�����Ƃ��� 1.8�� ����\�̍\������ɐ������� 10)�B�܂����������̓��^�����m�ۂł���AX ���̘I�����Ԃ������ĕ����̌�������� X ����܃f�[�^�����W���A������ 1 �{�����邱�ƂōX�ɕ���\�̌��オ���҂ł��邵�A���ː������̏��Ȃ� X ���\��������ł���Ɨ\�z�����B�������ACcO �͒ቷ���ł͎_�f�Ҍ����S�� X ���Ǝ˂ɂ���ĊҌ�����邱�Ƃ������̋z���X�y�N�g�����肩�疾�炩�ɂ��ꂽ�B�����ŁA�� 200 �̌������g�p���� X ���Ҍ����ł��邾���}���� X ���\�������肵�w�� a3-CuB ���j���S�̊Ԃɉߎ_�����̑��݂����肷�邱�Ƃ��ł��� 11)�B
4�D X �������\���ɂ�����E�ʊ�����
4.1. ��C�I�����E�ʊ����܂̎�ނɂ�錋�����̕��q�p�b�L���O�̕ω�
�@Brij-35 �ABL-8SY �y�� β-DM �� 3 �̔�C�I�����E�ʊ����܂��������̕��q�̃p�b�L���O�ɂǂ̂悤�ȉe����^�������� X �������\������l�@����B β-DM �ʼnn������ CcO �W�i���瓾��ꂽ�����́A�E�ʊ����܂ɕ����Ă���a�����̈�͌����`���Ɋ֗^���� 2 �ʑ̂̃E�V�S�� CcO �i�} 2�A�ԐF�j�̐e�����̈���l������Ίp����ɗאڕ��q�����͂ނ��ƂŁi�} 3�A���F�j�A���q�S�̂̓������ŏ����ɗ}�������z�I�ȕ��q�p�b�L���O�ł������B����ABrij-35 �� BL-8SY �ʼnn�������W�i���瓾��ꂽ������ X ���\���ł́A���Ԃ̑������q�p�b�L���O�̂��ߌ������̕��q�͕s����ł���ᕪ��\�̌����ƂȂ��Ă��� 12)�B AE �̃I�L�V�G�`�������̌J��Ԃ��\���͉^�����������A�����`���̌��ƂȂ�e�����̈�̑��ݍ�p�ɂ��e����^�����̂ɑ��Aβ-DM �̃}���g�V�h�̉^�����͒Ⴂ���ߐe�����̈�̑��ݍ�p�ɉe���͂Ȃ������`���ɍœK�̕��q�ԑ��ݍ�p������ꂽ�ƍl����ꂽ�B

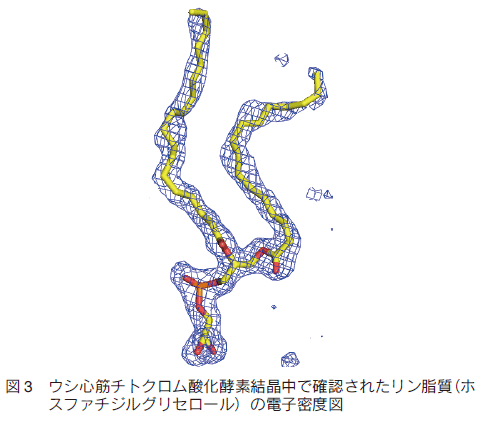
4.2.�����ƊE�ʊ����܂̗��̍\�����
�@ �E�ʊ����܂́A���^���p�N���Ǝ�����d�w�̊Ԃ�藣���đ���̑a����������邽�߁A���^���p�N��-�����Ԃ̗��̍\�����܂߂����ݍ�p��͍͂���Ȃ悤�Ɏv����B�������A1.8�� �܂� X ���\���̕���\�����߂�Ǝ����̖��Ăȓd�q���x���ϑ����ꂽ�i�} 3�j�B�e�P�ʑ̂ɂ́A�J���W�I���s�� 2 ���q�A�z�X�t�@�`�W���R���� 1 ���q�A�z�X�t�@�`�W���G�^�m�[���A�~�� 3 ���q�A�z�X�t�@�`�W���O���Z���[�� 4 ���q�A�g���A�V���O���Z���[�� 3 ���q�� X ���\���Ō��o���ꂽ�i�} 4�j�B�����̎����̎�ށA���b�_�̍����Ȃǂ͎��ʕ��͂����ʂȂǂœ���ꂽ���ʂƂ悭��v�����B�܂������̖����ɂ��ẮA�T�u���j�b�g�V�Ɋ܂܂�� 3 ���q�̃��������i 2 ���q�̃z�X�t�@�`�W���O���Z���[���� 1 ���q�̃z�X�t�@�`�W���G�^�m�[���A�~���j�͊������S�ւ̎_�f�����𐧌䂵�Ă��邱�ƁA���� 10 ���q�̓T�u���j�b�g�Ԃ������͓�ʑ̊Ԃō\���̈��艻�Ɋ�^���Ă��邱�Ƃ����炩�ƂȂ��� 13), 14)�B�@���^���p�N���ł́A�ŗL�̎����̖����ɂ��ČÂ�����c�_�����邪�A�E�ʊ����܂̓K�ȑI���ɂ���Đ����ɉ��w�\���Ɨ��̍\�������肵�A���̋@�\����邱�Ƃ��\�ƂȂ����B����ɁA�n���Ɏg�p�����R�[���_�� β-DM �̓d�q���x���ϑ����ꂽ�i�} 5�j�B���肳�ꂽ 4 ���q�̃R�[���_�͖��^���p�N���̐e�����̈�Ƒa�����̈�̊E�ʕt�߂Ɉʒu����X��������̂ɑ��āA2 ���q�� β-DM �͑a�����̈�̐^�Ɉʒu���Ă����i�} 4�j�B�O�҂̌��ʂ͖��^���p�N���̖�����n�����邽�߂ɂ͐��̖����\�����郊�������Ɩ��^���p�N���̑��ݍ�p����߂邱�Ƃ��K�v�ł��邽�߁A�R�[���_�̂悤�ȃC�I�����E�ʊ����܂��L���ł��������Ƃ������Ă���B�������A���艻�ɂ͓��Y���^���p�N���̐��Ƃ̒��ڂ̐ڐG��h���i���̂��߂ɂ̓R�[���_�ŏ\���ł���͂��ł���B�j�����ł͕s�\���ł���Aβ-DM �ւ̌������K�{�ł��邱�Ƃ���҂̌��ʂ͎����Ă���B���̂悤�ȊE�ʊ����܂� 2 �̈قȂ�����ɒ��ڂ����E�ʊ����܂̒T���͂قƂ�Ǎs���Ă��Ȃ��B���̂悤�Ȏ��_�̓����ɂ�薌�^���p�N�������������T���̉\���͔���I�Ɍ��シ��ƍl������B

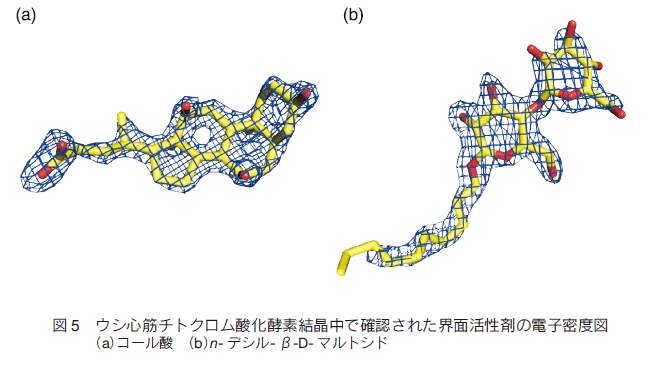
5�D �V�����E�ʊ����܂ɂ�镪��\�̌���
�@2 �͂ŏq�ׂ��悤�� β-DM �̎g�p�͂��̍y�f�̍\���𖾂ɍł��d�v�Ȉ��q�ł��������A���̑��̊E�ʊ����܂��X�Ȃ镪��\����ɂȂ���\���͏\���ɂ���B������ 1997 �N�����Ɏs�̂œ���\�Ȃ��ׂĂ̊E�ʊ����܂Ō������s������ β-DM �ȏ�̗ǎ��̌����͓����Ȃ������B�����ŁAβ-DM �����[�h�������Ƃ����V�����E�ʊ����܂̍����ɒ��肵���B�܂� β-DM �̍\����P�������ēł���}���g�[�X��P���ł���O���R�[�X�ɂ����f�V��- β-D- �O���R�V�h�����������B�������A�e�����̐��_��̐��������ɂȂ������߂����n�����啝�Ɍ��������B�����ŁA���n�������コ���邽�߂ɒY�f�� 10 �̃A���L����ƃO���R�[�X�̊ԂɃG�`�����O���R�[������������� 3- �I�L�T�g���f�V��-α-�}���m�V�h���������ACcO �������쐻�����Ƃ��� 1.8�� ����\�ȏ�� X ����܃f�[�^�̎��W�ɐ��������i�����\�f�[�^�j�B�} 6 �ɂ���܂łɓ���ꂽ�����̎ʐ^�Ɣ�C�I�����E�ʊ����܂̍\���������B
6. �@�܂Ƃ�
�@���ˌ������{�݂̏[���A��̓\�t�g�E�G�A�̊J����ėp���̌���Ȃǂ� X ����͋Z�p�̊J���͖ڂ���������̂�������̂́AX ��������͂̐��ۂ͌������ɂ���Č��܂邵�A�������̐��ۂ͖ړI�̃^���p�N���������ɗ��̍\���Ȃ����ƂȂ��������邩�ɂ������Ă���B����܂ł̌��ʂ���A���^���p�N���̏ꍇ�́A�ǂ̊E�ʊ����܂��ǂ̒i�K�ŗp���邩�����������̉ۂ����߂邱�Ƃ����炩�ƂȂ����B�E�V�S�� CcO �̏ꍇ�A�~�g�R���h���A��������̉n���̓R�[���_�ōs���A���̌�̔�C�I�����E�ʊ����܂̃A���L����̒Y�f���� 10 �Őe�����͓��ł��邱�Ƃ��K�ł���悤�Ɏv����B�������A���ِ̈��̂͐��������݂��邽�߂��̑��̊E�ʊ����܂��f�U�C������Ε���\�����シ��\���͔ے�ł��Ȃ��ł��낤�B��X�͍\���̒P������ڎw�������q���f�U�C���������A���̂��ߊE�ʊ����܂̃~�Z���`�����ɂ����鐅�n���̖����������˂Ȃ�Ȃ������B�t�Ƀ}���g�[�X�ƃA���L����� 2 �ɂ������G�ȊE�ʊ����܂���������A�ۂ̖��[�_���y�f�ł͐����W�i�̈��艻�Ɋ�^�����Ƃ̕�����邽�� 15)�A�܂��܂��J���̗]�n�͂���ł��낤�B
�@�{�e�ŏЉ�����e�́A���Ɍ�����w��w�@���w�����ȋg��M��A�����y���������̃O���[�v�Ƃ̒��N�̋��������̐��ʂł���B�܂��E�ʊ����܂̍����́A���Ɍ�����w��w�@���w�����Ȑ������u�����̎w���̉��ōs��ꂽ�B�e�O���[�v�����̑����̕��X�Ɍ������ӂ���B
| ���҃v���t�B�[�� | |
| ���� | �R �_�iAoyama Hiroshi�j |
|---|---|
| ���� | ����w��w�@��w������ |
| �A���� | ��565-0871�@���{���c�s�R�c�u 1-6 |
| haoyama@phs.osaka-u.ac.jp | |
| �w�� | ���m (���w) |
| ���݂̌����e�[�} | X ��������͂Ɋ�Â��������ۂ̗����Ɩ�w�̈�ւ̓W�J |
| Copyright(c) 1996-2015 DOJINDO LABORATORIES,�@ALL Rights Reserved. |