 |
| トップページ > 「蛍光生物学」の最前線 4 |
 |
|||||||||||||||
「蛍光生物学」の最前線 4
1.はじめに蛍光バイオイメージングは観察対象物質に蛍光性を付与することにより高感度、多色で動的にイメージングが可能な手法として、バイオメディカル分野における研究や診断において不可欠なツールとなりつつある。多くの場合観察には可視光の蛍光が用いられている。通常の蛍光では励起光が蛍光に対して短波長である必要があり、可視光の蛍光を得るためには紫外光や短波長可視光が用いられる。これらの波長の短い励起光は同時に量子エネルギーが高く、分子の光分解により有機系蛍光体の退色や観察対象である生体へのダメージ、観察対象以外の自家蛍光を招く。さらには波長が短いために起きる強い散乱のために観察深度は浅くならざるを得ない。光散乱は光損失によって励起光や蛍光の強度が損なわれるばかりでなく、光がランダムな方向に散ることから像のボケをもたらす。図 1 に示したのは人間の皮膚による光損失である 1)。可視光近傍の光の損失は主に短波長ほど強い光散乱と、2000 nm 以上の波長域にピークを持つ分子振動による赤外吸収の裾によってもたらされ、1000 〜 1700 nm の近赤外波長域で谷を形成する。この光透過性の高い波長域は古くから「生体の窓」として知られている 2)。この図から特に可視光領域では光散乱による損失が強いことが読み取れ、蛍光バイオイメージングにおける蛍光波長の長波長化は一つのトレンドになっている。しかし、近年実用化したインドシアニングリーン(ICG) 3)や量子ドット 4, 5)でもその蛍光波長は 900 nm にとどまっており、「生体の窓」が十分に活用されているとは言えない。その主たる理由は現在用いられている CCD カメラの大部分が Si の CCD であり、その観察波長が 1000 nm 以下に限られているためである。一方近年、1000 〜 1700 nm で観察が可能な InGaAs CCD カメラが入手可能になり、その性能も急速に進歩しつつある。筆者らはこのカメラを用いてイメージングシステムを開発し、希土類含有セラミックスナノ発光体 (RED-CNP: rare-earth doped ceramic nanophosphor)を蛍光体としたアップコンバージョン(UC)蛍光バイオイメージング及び OTN-NIR (over-1000-nm near infrared)蛍光バイオイメージングに取り組んできた 6, 7)。本稿では蛍光体としての RED-CNP の作製方法と表面機能化にフォーカスし、その研究成果を紹介する。 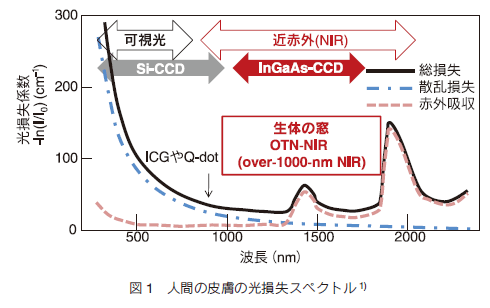 2.希土類含有セラミックスナノ粒子と近赤外励起蛍光3 価の希土類イオンは[Xe] 4fN-15s25p6 の電子配置をとることから、 4f 電子準位間で遷移が起こる一種の遷移金属である。一般に知られる d 電子準位に空軌道のある遷移金属イオンとの違いは、第一に空軌道のある 4f 電子準位に対して空間的にはさらに外側にある 5s5p 電子準位が充満しており、これらの電子が 4f 電子に対して遮蔽効果を持ち、イオン周囲に存在するイオンや分子による外場や振動の影響が弱められることである。結果として 3 価希土類イオンの電子準位は溶媒効果や結晶場によるシフトが小さく、図 2 に示すように指紋判別式に観察されるスペクトルの電子遷移を特定することができる。また観察されるスペクトルは原子スペクトルにも似て線幅が極めて狭い。さらにはイオンや分子の振動から遮蔽されているために熱緩和を起こしにくい。第二に 4f 電子準位間の遷移は本来パリティー禁制であり、外場の影響によりわずかに許容になる forced electric dipole 遷移と、許容の電気双極子遷移よりもはるかに振動子強度が小さい磁気双極子遷移、電気四重極子遷移が主な遷移機構であるため、発光を伴う緩和が極めてゆっくり起こる。以上の特徴に起因して、希土類イオンの発光に際し、狭い準位幅、長い励起状態寿命(蛍光寿命)、高い発光効率を特徴とする 8)。また、可視光付近で発光を示す準位間隔が 1 〜 2 eV 程度であり、室温 kBT が約 0.025 eV 程度であることを考えると 1 eV 以下(1240 nm 以上相当)の近赤外発光準位では格子振動や分子振動の相互作用が強くなり、通常の蛍光体では効率の良い発光を望むことが難しいが、希土類イオンはこの相互作用が弱められ、比較的高い効率で近赤外光を発光できる。 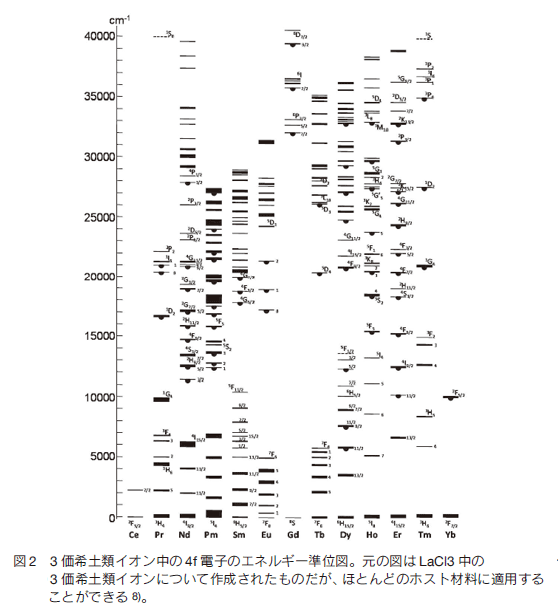
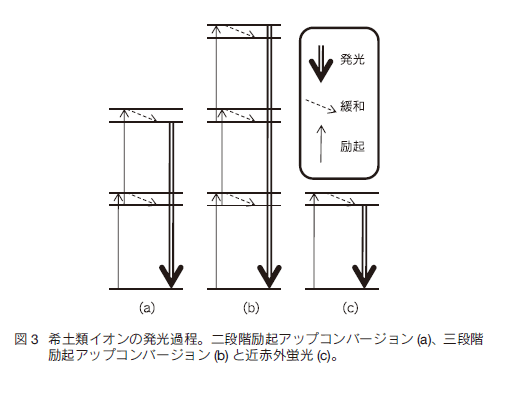 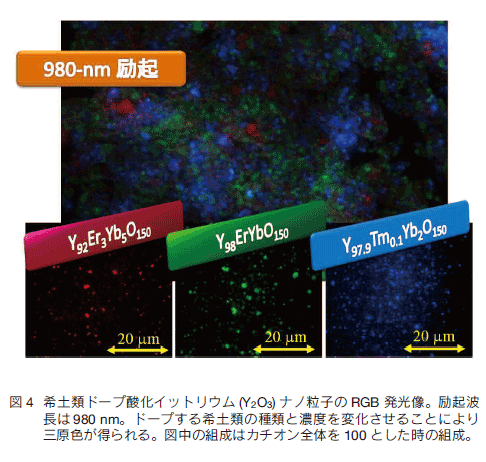
以上のように希土類ドープセラミックスは近赤外励起による効率の良い可視・近赤外発光が可能であり、これをナノ粒子化し蛍光バイオイメージングプローブとして用いれば、励起光として短波長光を用いることに起因する蛍光体の退色、生体へのダメージ、自家蛍光、光散乱による損失という現在の蛍光バイオイメージングが抱えるすべての問題を一気に解決することができる。UC 蛍光のバイオイメージングは、励起光源をコンパクトかつ安価な半導体レーザーに変更するだけで可能になることから 1990 年代後半からすでに報文が発表され始めた 12)。筆者らはイメージングシステムに OTN-NIR である 1000 - 1700 nm でイメージングが可能な InGaAs CCD カメラを組み込めば、多段階励起を必要とする UC よりもはるかに高い効率で励起が可能であり、蛍光も近赤外光であるために生体における蛍光のロスが少ない OTN-NIR 蛍光バイオイメージングに独自に取り組んできた 13)。蛍光プローブ設計の観点からは UC、OTN-NIR に共通のスキームを用いることができる。 3.イメージングシステムUC 蛍光や OTN-NIR 蛍光でのバイオイメージングを行うために開発した二つのイメージングシステムを図 5に示す。市販されている蛍光イメージングシステムの主なものは生物蛍光顕微鏡と小動物を生きたままイメージングできる in vivo 蛍光バイオイメージング (IFBI) システムである。これらで UC/OTN-NIR 蛍光を観察可能にするためには、励起光源として近赤外レーザーダイオードを搭載する必要がある。また、OTN-NIR 蛍光を観察するためには InGaAs CCD カメラを搭載しなければならない。両システムとも UC 蛍光による可視光を観察するための Si CCD と OTN-NIR 蛍光を観察するための InGaAs CCD カメラの双方を搭載している。 
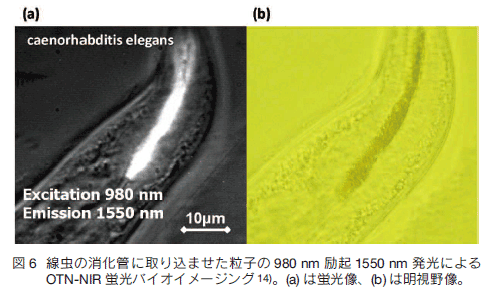
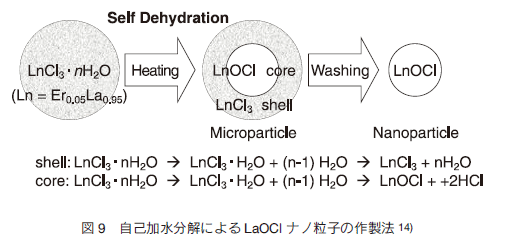
 4.セラミックスナノ粒子の合成 RED-CNP の設計は所望の励起波長と蛍光波長を図 2 と見比べて始まるが、特にフォノンエネルギーに注目したホストの選定と 16)、エネルギー移動などの諸現象に注目した濃度の設定 17-19) が必要である。著者らは主に Er、Tm、Ho を Yb と共ドープした Y2O3 、YPO4、 LaOCl 、NaYF4 を中心に研究を進めている。バイオイメージング用のプローブとして RED-CNP のサイズは 10 〜 300 nm 程度であることが望ましい。10 nm を切ると、希土類イオンがホストの外の分子やイオンの外場の影響を受けて発光しにくくなる。発光の上ではいくら大きくても構わないが、生体応用を考えると水溶液中での単分散安定性が前提であり、あまり粒子サイズが大きいと沈降してしまうことから、我々は上限を 300 nm 程度に設定している。粒径分布は重要であり、第一義的に粒子の発光強度は粒子中の希土類イオンの数に比例する体積に比例し、粒径の三乗に依存して変化する。このため均一粒径で 10〜 300 nm の範囲で粒径をコントロールすることが課題となる。 
 5.セラミックスナノ粒子の機能化 得られた RED-CNP は表面電位を持つために純水中では分散するが、イオン性の水溶液では表面電位がイオンによりキャンセルされ、凝集沈降する。バイオイメージングでは生理環境に相当するイオン強度の水溶液中での分散が必須であり、このために親水性高分子を粒子表面に導入し、立体反発による分散安定性を付与しなければならない。また、粒子そのものは非特異的に観察対象以外の細胞や組織と相互作用するため、標的の物質を染め分けるためには非特異的な相互作用を抑制しなければならない。さらには特定の細胞や物質に蛍光性を付与するための特異的な相互作用の導入が必要である。この三条件、すなわち分散安定性、非特異的な相互作用の抑制、特異的な相互作用の付与を目的として、筆者らは毒性がなく生体親和性が高いことで知られるポリエチレングリコール(PEG)とリガンド分子を粒子表面に導入する種々の方法を検討している。 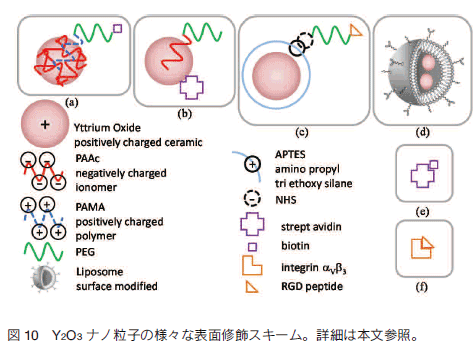 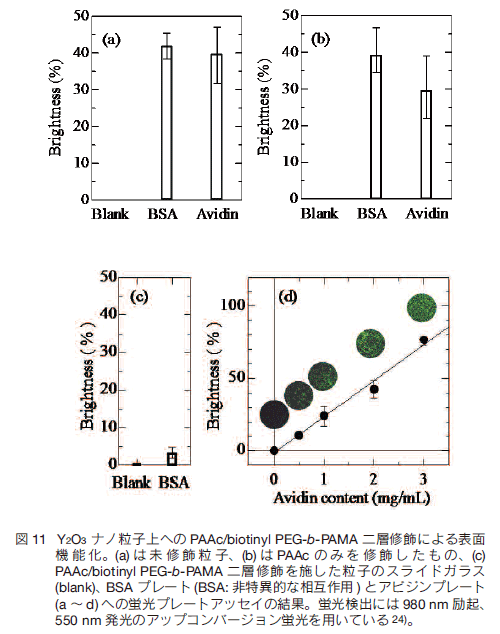 スキーム (b) では水溶液中で負に帯電するアイオノマーである PAAc と PEG のブロック共重合体である PEG-b-PAAc を用いることにより、正に帯電した Y2O3 ナノ粒子の表面と負に帯電する PAAc を静電的に相互作用させることにより PEG を導入し、同時にアビジンを粒子表面に導入している。 Y2O3 ナノ粒子の表面と PAAc の相互作用は静電的なイオン間の相互作用にとどまらず、カルボキシル基と Y3+ 間のキレーティングが多点で起こるために強固に粒子表面に PEG を導入することができる。この方法でも分散安定性、非特異的な相互作用の抑制、ビオチン化プレートとの特異的な相互作用が確認されている 25)。上村らは近年同様に有用なリン酸基を有するポリマーブロックとのブロック共重合体として PEG-b-poly (4-vinylbenzylphosphonate)(PEG-b-PVBP)を開発し、OTN-NIR IFBI を行っている 26)。  スキーム (d) ではリポソーム中に Y2O3 ナノ粒子を導入している。リン脂質二重膜からなり、動物細胞の表面と同じ構造を持つリポソームは、種々の分子が結合したリン脂質を表面に導入可能であり、表面電位の調節やリガンド導入が容易に行える上、細胞との膜融合によりリポフェクションによる粒子の細胞内への送入が可能である 28) ことから、薬剤やイメージング用蛍光体のデリバリーに有用な材料である。筆者らは RED-CNP を導入したリポソームを作製し、マウスに投与することによりその挙動を OTN-NIR IFBI を用いて解析している 29)。 6.おわりに 近赤外光を励起光とし、RED-CNP を蛍光体とした UC 蛍光バイオイメージングと、特に次世代の IFBI 技術として期待を集める OTN-NIR 蛍光バイオイメージングについて総説した。特に OTN-NIR IFBI はこれまでにない深部のイメージングが可能な新たな手法として今後の発展が望まれる技術である。これらの技術については著者への問い合わせを歓迎する。 謝辞ここに紹介した研究は筑波大学の長崎幸夫教授とグループメンバー、理化学研究所の座古保氏をはじめとする前田バイオ工学研究室のメンバー、東京理科大学の岸本英博准教授とグループメンバー、田代文夫教授とグループメンバーをはじめ、多くの方との共同研究により得られた研究成果であり、これらの方々に心から謝意を表する。
|
|||||||||||||||
| Copyright(c) 1996-2012 DOJINDO LABORATORIES, ALL Rights Reserved. |
