 |
| トップページ > アルツハイマー病アミロイドβペプチド(Aβ)に結合する人工分子の構築とAβ集合体形成の制御 |
 |
||||||||||||||||||||
アルツハイマー病アミロイドβペプチド(Aβ)に結合する人工分子の構築と
|
||||||||||||||||||||
|
|
||||
Protein misfolding is closely related to the neurodegenerative diseases such as Alzheimer’s disease (AD) and Huntington’s disease. In AD, amyloid β-peptide (Aβ) is a principal component of the cerebral plaques found in the brains of patients. In vitro studies revealed that Aβ is capable of self-assembling into amyloid fibrils via several oligomeric states. In recent advances, soluble oligomeric species of Aβ are more toxic to neuronal cells than monomeric form and mature fibrils of Aβ. In this review, we describes the construction of molecules capable of interacting with Aβ to control the aggregation of Aβ. In vitro selection using an RNA pool against Aβ was performed to construct RNA aptamers against Aβ. Selected RNA aptamers bound to Aβ1-40 and inhibited the aggregation of Aβ1-40. We also designed the peptides, based on the sequence of Aβ14-23, capable of forming amyloid-like fibrils by capturing soluble Aβ oligomers. Moreover, designed protein variants, based on the β-barrel proteins such as green fluorescent protein (GFP) and insulin-like growth factor 2 receptor domain 11 (IGF2R-d11), comprising pseudo-Aβ β-sheet structures, inhibited the Aβ aggregation efficiently. These studies contribute to understanding how protein misfolds and designing the therapeutic reagents against AD. キーワード:タンパク質ミスフォールディング、アルツハイマー 病、アミロイド線維、アミロイドβペプチド、RNAアプタマー、 設計ペプチド・タンパク質 |
|||||
1.はじめに
超高齢化社会となりつつある現在の日本において、アルツハイマー病などの認知症に関わる病気の克服は、最も重要な課題の一つである。アルツハイマー病の特徴として、患者の10%を占める遺伝性の家族性アルツハイマー病に対して残りの90%は孤発性(非遺伝性)であり、誰もが発症しうる病気であるため、その患者数は社会が高齢化するに従い右肩上がりで増えていくと予想される1)。弧発性アルツハイマー病の多くは、高齢になってから発症することから、その加齢と病気の関わりが指摘されている。アルツハイマー病患者の症例の特徴として、アミロイドβペプチド(Aβ)が繊維状に凝集したアミロイド線維の沈着による老人斑の形成とTauタンパク質の異常リン酸化による神経原線維変化が知られている2)。中でもAβの沈着は、タンパク質のミスフォールディングと密接に関連しており、病気と関連した研究のみならず、ペプチド・タンパク質の一般的性質の理解の観点からも興味深い研究対象であり、現在世界中の多くの研究者がAβ関連の研究を推し進めている。これまでの研究から、Aβの集合体、中でも可溶性オリゴマー集合体が高い細胞毒性を示すことが培養細胞を用いた実験から明らかとなってきている3,4)。またマウスを使った実験でもAβオリゴマーがシナプス可塑性の長期増強を低下させることも示されている5)。しかしながら、生体内においてどのようにAβオリゴマーやアミロイド線維が生成するのか、それがどのように神経細胞の機能を破壊しているのかは未解明の課題として残っているのが現状である。
一方、タンパク質のアミロイド線維形成は、アルツハイマー病のみならずパーキンソン病やハンチントン病などの多くの神経変性疾患の発症に関与している6)。通常のタンパク質は、構造が崩れたり、フォールディングに失敗した場合、速やかに細胞がもっている品質管理システムにより分解・除去される。ところが、何らかの因子の作用やタンパク質の品質管理システムが機能せず、その結果ミスフォールディングしたタンパク質が凝集し、最終的に不溶性のアミロイド線維へと集合化・構造変換する場合がある。タンパク質のミスフォールディングと疾患との関連について明らかにすることは、多くの神経変性疾患の克服に繋がる可能性を秘めている。筆者らはこれまで、アルツハイマー病Aβのミスフォールディングと凝集体形成に着目し、試験管内においてAβの集合化を制御することができる人工分子の開発を精力的に進めてきている7-12)。ここでは、そのいくつかについて簡単に紹介させていただく。
2.Aβの構造と集合化
まずAβの性質について簡単に述べる。Aβは膜貫通タンパク質であるアミロイド前駆タンパク質から切り出されて生成する約40個のアミノ酸残基からなるペプチドである(Fig.1A)。生成したAβは通常速やかに代謝経路に従い除去されると考えられている。試験内実験からAβは数十から数百μMでインキュベートすると時間とともに集合化し、最終的にアミロイド線維と呼ばれる安定な繊維状集合体を形成する(Fig.1B)。特に加齢とともに生成量が増大する42残基からなるAβ1-42は凝集性が高く、nMレベルの低濃度でも会合することが明らかとなっており、通常生成するAβ1-40とAβ1-42の存在比の変化もアルツハイマー病発症に関与していることが示唆されている13)。
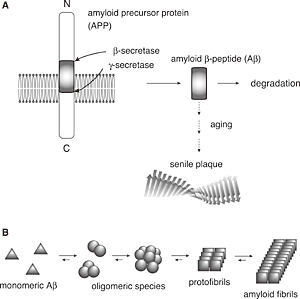
Fig.1(A) Schematic representation of the generation of Aβ. Aβ is the main component of senile plaques in patients with Alzheimer’s disease. (B) Schematic illustration of Aβ aggregation into amyloid fi brils.
このAβの集合化・凝集体形成においての構造的性質として、単量体のAβはランダムコイル構造であり、集合化に伴いβシートの構造形成が誘起される。またNMR測定からアミロイド線維の構造が推定されており、ペプチド鎖が中央付近で折れ曲がった構造をとり、それが平行βシート構造を形成して連なった構造がモデルとして提唱されている14,15)。このAβなどのアミロイド性ペプチド・タンパク質の性質として、自己の配列を認識して集合化する点がある。すなわち、Aβの集合化を阻害する分子デザインとしてAβと似た配列をもつ分子の構築が有効となる。このような設計指針で様々なペプチドが合成され、そのいくつかは効果的にAβの集合化を抑制し、現在臨床応用へ向けた研究が展開されてきている。
3.Aβに結合するRNAアプタマーの選択とAβ集合化阻害
1990年代初頭から盛んに研究されてきているRNAやDNAを用いた試験管内分子進化法は、特定の化合物に結合する分子を獲得する有力なツールとしてファージディスプレイ法と並び発展してきている。RNAはDNAと比較して多様な高次構造を形成しやすいため、より特定の化合物に結合する分子を選別しやすい利点を有している。この方法によりプリオンタンパク質に結合するRNAアプタマーも獲得されている。そこで筆者らはRNAを用いた試験管内分子進化法を適用し、Aβに結合するRNAアプタマーの獲得を試みた7)(Fig.2)。
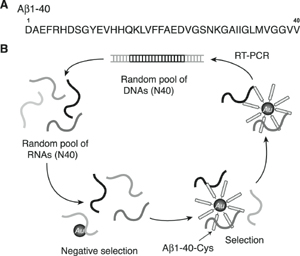
Fig.2 Schematic illustration of in vitro selection of RNA aptamers that bind to the Aβ1-40 conjugated with the colloidal gold.7
まず、40残基からなるAβ1-40を標的化合物として、その配列のC末端にシステインを配置したペプチドを調製した。このペプチドを市販の金コロイド粒子(直径10nm)にチオールと金との相互作用により集積したAβ結合金ナノ粒子を合成し、これを標的として選別操作を試みた。RNAは、40塩基のランダム領域を含むライブラリを調製し、それをAβ結合金ナノ粒子と相互作用させ、遠心分離によりAβに結合するRNAを選別した。このサイクルを繰り返すことにより、Aβにより強く結合するRNAを獲得した。得られたRNAのいくつかを単離し、Aβ結合金ナノ粒子との結合能を評価した結果、2つのRNA(E2,N2)が強くAβと結合することが分かった。蛍光標識したRNAを調製し、蛍光異方性測定からE2およびN2 RNAとAβ1-40との解離定数を算出したところ、それぞれ10.9μMと21.6μMと算出され、本手法で獲得したRNAがある程度の結合力でAβと相互作用することが示された(Fig.3A)。
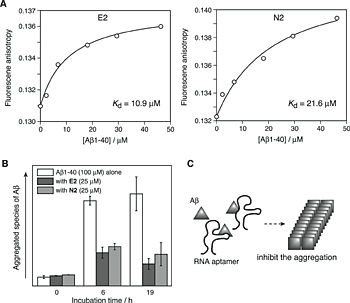
Fig.3(A) Fluorescent anisotropy changes of fluorescein-labeled E2 (left) and N2 (right) as a function of Aβ1-40 concentrations. Dissociation constants (Kd) are estimated by using an equation with assumption of 1 : 1 stoichiometry. (B) Inhibition of Aβ1-40 aggregation by E2 and N2 RNA aptamers. Aβ1-40 (100 μM) was incubated with or without RNA aptamer (25 μM) at 37°C for several hours, and the aggregation of Aβ was detected by an ELISA assay. (C) Schematic representation of the inhibition of Aβ aggregation by RNA aptamers.7
次に獲得したRNAを用いてAβ1-40のアミロイド線維形成の阻害能について評価した。RNA(25μM)存在下にてAβ1-40(100μM)をインキュベートしたところ、Aβの凝集体形成を顕著に阻害することが分かった(Fig.3B)。N2RNAよりもE2RNAがより強くAβの線維形成を阻害したことから、RNAとAβの結合親和性がAβの集合化阻害に寄与していることが強く示唆された(Fig.3C)。しかしながら、より強い集合化能・線維形成能をもつAβ1-42を用いた場合では、今回獲得したRNAによる集合化阻害はみられなかった。Aβ1-42は、Aβ1-40と比較してより低濃度で集合化することが知られている。今回獲得したRNAはAβに対して解離定数として10-20μM程度の親和性しかもたなかったために、Aβ1-42の集合化を阻害できなかったものと推察される。
今後はより強く結合するRNA分子を獲得することで、凝集能が高いAβ1-42の集合化やアミロイド線維形成を阻害するRNAを創製できると期待される。
4.設計ペプチドによるAβオリゴマーの取り込みと線維形成による毒性制御
上記のRNAを用いた系では、Aβとの結合力はそれほど強くなく、集合化能の高いAβ1-42の集合化を阻害することはできなかった。Aβの集合化は自己認識により引き起こされるが、ひとたびできたAβの凝集体やアミロイド線維が鋳型として機能し、集合化していない単量体のAβや小さいオリゴマーの集合化を促す核依存性を示すことが知られている。そのため、Aβの集合体形成を阻害する分子を構築するためには、ある程度の強さをもって阻害しないと、阻害できずに生成した少量の線維が核として働いてしまう。一方、Aβによる神経細胞毒性は、アミロイド線維よりもAβ分子が数個から数十個集合化した可溶性オリゴマーが高い毒性を示すことが近年の研究から分かってきており、現在ではこの可溶性オリゴマーがアルツハイマー病発症における毒性の本体の一つであると考えられてきている。そこで筆者らは、このAβの可溶性オリゴマーやアミロイド線維に結合して、共線維形成するような人工ペプチドを構築した。これにより、細胞毒性を示す可溶性オリゴマーやアミロイド線維をペプチドが形成する線維の内部に取り込み、結果として生じたアミロイド様線維がAβよりも低毒性を示すことを期待した8-10)(Fig.4A)。
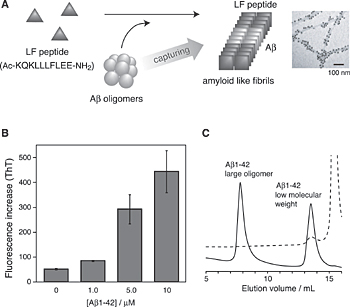
Fig.4(A) Schematic representation of capturing Aβ1-42 oligomers using the designed peptide, LF. Transmission electron microscopy measurements revealed that Aβ species detected by immuno-staining with gold nanoparticles appeared with the peptide amyloid-like fibrils. (B) Fluorescence increase of thioflavin T (ThT) before and after 8 hours incubation of the LF peptide (100 μM) with and without matured Aβ1-42 fibrils (0, 1, 5, 10 μM / monomer). Incubation was carried out at 37°C. (C) Size-exclusion chromatography (SEC) analysis of the supernatants after centrifugation before (solid line) and after 2 hours of incubation with LF (dushed line) on a Superdex 75 column.8,9
ペプチドの設計として、Aβの線維形成に重要な領域である中央付近の14残基目から23残基目までの配列(Aβ14-
23;HQKLVFFAED)を参考にし、その配列を単純化したAc-KQKLLXFLEE-NH2配列を設計した。この配列のXの位置に種々のアミノ酸(Leu,Val,Ala,Thr,Phe,Tyr)を導入し(LF,VF,AF,TF,FF,YF)、疎水性度による線維形成能が異なることを期待した。これら人工ペプチドが、鋳型となるAβアミロイド線維と相互作用してβシート構造が誘起され、それが逆平行βシート構造を形成して集合化することでアミロイド様線維を形成することを期待した。
まずペプチド単独での線維形成能をチオフラビンT(ThT)アッセイおよび透過型電子顕微鏡観察(TEM)により評価した。ThTはアミロイドに結合して蛍光強度が増大する色素である。線維形成を促進するtrifluoroethanol(TFE)存在下において、LF, FFが顕著にアミロイド様線維を形成することが分かった。VFペプチドはThT蛍光は低いもののTEM観察ではアミロイド様線維を確認した。これに対し、AF, TF, YFはアミロイド様線維を形成しないことが示された。このように単純なアミノ酸配列で設計したペプチドの疎水性度を変えることでペプチド自体の集合化能・線維形成能を劇的に変化させることができた。そこで線維形成能に優れたLFペプチドを使って、Aβの可能性オリゴマー共存下における人工ペプチドの線維形成について検討した。
LFペプチドとあらかじめ調製したAβオリゴマーを含む溶液を混合し、8時間インキュベートしてThTアッセイを行ったところ、Aβ濃度依存的にThT蛍光が増大した(Fig.4B)。このことからLFペプチドがAβオリゴマーを鋳型として線維形成していることが確認された。次に、核として利用したAβオリゴマーがLFペプチド線維の中に定量的に取り込まれていることを確認するために、インキュベートした溶液を遠心分離し、その上清をサイズ排除クロマトグラフィー(SEC)分析した(Fig.3C)。その結果、Aβオリゴマー由来の溶出体積8mL付近のピークは完全に消失していることが分かった。これに対し単量体と推察される溶出体積13.5mL付近のピークは残存していたことから、オリゴマー体がより効率的に人工ペプチドと相互作用して、線維に取り込まれていることが推察された。Aβ抗体と金コロイド粒子を使った実験で実際に線維の中にAβオリゴマーが取り込まれているか確認したところ、先ほどのAβアミロイド線維を使ったときと同様にAβ分子が線維の中に取り込まれていることが確認できた。このようにLFペプチドは、Aβオリゴマーを鋳型として迅速にアミロイド様線維へと集合化し、その中にAβ分子を定量的にトラップできることが明らかとなった。また詳細は省略するが、LFペプチドは、Aβアミロイド線維を鋳型とした場合でも、その線維を鋳型として取り込みながらアミロイド様線維を形成することができる。このように、Aβの可溶性オリゴマーやアミロイド線維を鋳型として用いることで、鋳型表面を認識場として疎水的かつ電荷的相互作用により人工ペプチドが結合し、その結果人工ペプチドの線維形成が誘発されていると推察される。
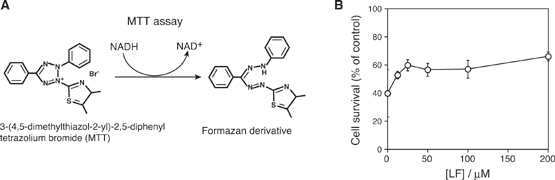
Fig.5(A) Schematic representation of 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT)assay to assess the live cells. (B) MTTassay of the PC12 cells in the presence of toxic Aβ1-42 oligomers(5.0μM /monomer)with or without LF peptide. Cells (2 x 104 /wells) were incubated with peptides at 37°C for 6 hours.10
このように構築したLFペプチドは、効率的に細胞毒性が高いAβオリゴマーを取り込むことが分かった。そこで、モデル培養細胞としてPC12細胞を用い、LFペプチドがAβオリゴマーの細胞毒性を抑制できるかについて検討した。細胞の生死判定法である3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT)法により評価したところ、Aβオリゴマーに対してLFを過剰に加えることでAβの細胞毒性を抑制できることが分かった(Fig.5)。現在、細胞毒性をより効率よく低減できるLFペプチドの変異体も既に獲得している。まだまだ改良が必要であるが、本手法により構築した人工ペプチドがAβオリゴマーを捕まえて共線維形成することで、その線維を増幅させかつ細胞毒性を抑制できることが示されたことから、将来的な臨床・診断検査応用への展開が強く期待される。
5.Aβ様βシート構造を提示したβバレル型タンパク質の設計とAβ集合化阻害
Aβの毒性を低下・中和する分子として、現在注目されているものの一つに抗体が挙げられる。抗体は特定の抗原分子に結合し、生体内での異物による毒性を中和する機能を担っている。数年前にアルツハイマー病治療法の一つとしてAβをワクチンとして抗Aβ抗体を体内で産生させる試みがなされ、痴呆の進行を遅らせる効果があることが報告された。Aβを直接ワクチンとして皮下注射する初期の方法は副作用のため現在中止されているが、この方法が示していることは、Aβに強く結合する抗体は、その毒性を低下させ、ひいてはアルツハイマー病の進行を遅らせることができることである。また他にも抗Aβ抗体がAβの神経細胞毒性を低下させることができると報告されている。筆者らは先に紹介したAβと相互作用する人工ペプチドの設計手法を拡張し、βバレル型タンパク質表面を認識場として用いる手法の開発を試みてきている。具体的には、Aβのβシート構造モデルを参照し、そのβシート部分の配列をβバレル型タンパク質のβシート部位にアミノ酸置換により挿入した人工タンパク質を設計した。この設計タンパク質がAβ分子とAβの代わりに抗体様に強く相互作用し、Aβ自身の集合化・アミロイド線維形成を阻害することができると期待した。
最初に緑色蛍光タンパク質(GFP)を土台とした分子設計を試みた8,11)。GFPはβバレル構造をもち、バレル構造にフォールドすることで自発的に発色団を形成する反応が進行し、結果強い蛍光を発する。このGFP構造は比較的安定で、その表面には平行型および逆平行型βシート構造を有している。挿入するAβ配列として、先に紹介したLFペプチドの設計において参照したAβ配列の14-23残基の部分を用いた。全長のAβは平行βシート構造を形成して線維形成することは先に述べたが、14-23残基目の配列は、単独では逆平行βシート構造を形成してアミロイド線維を形成することが知られている。両構造ともAβの中央付近の疎水性領域のアミノ酸側鎖間の相互作用がAβのアミロイド線維形成に大きく寄与している。筆者らはAβの平行および逆平行βシートのモデル構造を参考にし、GFP表面のアミノ酸残基をAβ由来のアミノ酸残基に置換して、GFP表面にAβ様βシート構造を提示した人工タンパク質を設計した(Fig. 6A)。GFPのβストランド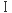 と
と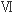 の平行βシート構造部位を利用して、Aβ14-23配列のアミノ酸を挿入したP13Hタンパク質を設計した。この際にGFP構造に与える影響を最小限にするために、バレル構造の内側のアミノ酸残基はそのままにした。またGFPのβストランド
の平行βシート構造部位を利用して、Aβ14-23配列のアミノ酸を挿入したP13Hタンパク質を設計した。この際にGFP構造に与える影響を最小限にするために、バレル構造の内側のアミノ酸残基はそのままにした。またGFPのβストランド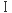 と
と の逆平行βシート部分にAβ配列を挿入したAP13Qを設計した。
の逆平行βシート部分にAβ配列を挿入したAP13Qを設計した。
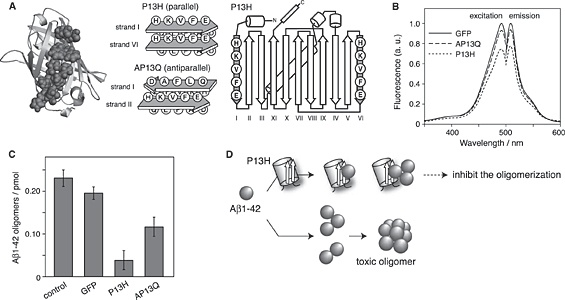
Fig.6(A) Schematic illustration of design of the GFP variants in which pseudo-Aβ β-sheets are embedded. Designed protein, P13H and AP13Q mimic the parallel and antiparallel β-sheet models, respectively, of Aβ amyloid fi brils. (B) Fluorescence excitation and emission spectra of GFP, AP13Q, and P13H. λex = 490 nm and λem = 510 nm. (C) Inhibition of Aβ1-42 oligomerization by GFP, P13H, and AP13Q. The amounts of Aβ oligomers were calculated from the data of ELISA. (D) Images of the inhibition mechanism of Aβ oligomerization using P13H variant.11
まず設計したタンパク質P13H,AP13Qの蛍光特性について評価した(Fig.6B)。GFPのスペクトルと比較してP13Hの蛍光強度が幾分小さいが、最大励起波長・蛍光波長がGFPとほぼ同じことから、設計したP13H,AP13Q共にGFPと同様の構造特性を保持していることが示唆された。次にこの人工タンパク質を用いてAβの集合化阻害実験を試みた。ここでは、Aβ認識抗体6E10とビオチン標識した6E10(bio-6E10)用いたELISAアッセイによりAβオリゴマーを定量することで各人工タンパク質の阻害能を評価した。人工タンパク質存在下でAβをインキュベートしたところ、インキュベートにより生成するAβオリゴマーの量が低下した(Fig.6C)。特に平行βシートを挿入したP13Hでは、オリゴマー生成を約1/6にまで抑制できることが明らかとなった。この結果はGFP表面に提示した擬Aβ平行βシート構造がAβとの相互作用に効果的に寄与し、その結果Aβのオリゴマー形成を強く阻害したものと推察される。
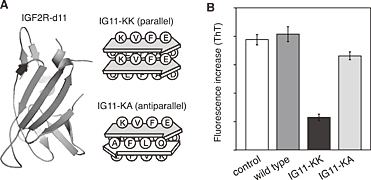
Fig.7(A) Schematic illustration of insulin-like growth factor 2 receptor domain 11 (IGF2R-d11) variants in which pseudo-Aβ β-sheets are embedded. IG11-KK and IG11-KA mimic the parallel and antiparallel β-sheet models, respec ively, of Aβ amyloid fi brils. (B) Inhibition of Aβ1-42 aggregation by IGF2R-d11 wild type, IG11-KK, and IG11-KA. ThT fl uorescence increases after 24 hours of incubation were shown. Aβ1-42 (40 μM) was incubated with or without protein (4.0μM).12
次に、この方法論を拡張するために、インスリン様成長因子2受容体ドメイン11(IGF2R-d11)を土台として用い、GFPの場合と同様にAβ様アミロイド構造を提示したタンパク質を設計した12)(Fig.7A)。IGF2Rは15個の細胞外ドメインからなる細胞表面レセプターであり、人の組織に遍在する多機能性タンパク質である。ドメイン11は、インスリン様成長因子2(IGF-II)と相互作用する疎水性ポケットをもち、単独でIGF-IIと高い親和性を有している。その構造はX線結晶構造解析から明らかとなっており、βバレル様の構造をとり、表面にβシート構造をもっている。そこで、先のGFPの系と同様に、IGF2R-d11の平行βシート部位にAβ由来の配列を挿入したAβ様アミロイド挿入タンパク質(IG11-KK)を構築した(Fig.7A)。また逆平行βシート部位にAβ由来の配列を挿入したIG11-KAも合わせて構築した。アミロイド線維を検出するThTアッセイから、構築したIG11-KKは、wild typeのIGF2R-d11やIG11-KAと比較して、効果的にAβ1-42のアミロイド線維形成を阻害した(Fig.7B)。このことから、GFPの場合と同様、平行βシート部位へのAβ様アミロイド構造の挿入がAβの集合化阻害に有利に働いていることが示唆された。特に、RNAアプタマーでは阻害できなかったAβ1-42の集合化を阻害できることが示された。これらの実験だけではまだ不十分ではあるが、Aβのアミロイド線維構造のモデルと合わせて考えると、Aβの集合化の初期段階からすでに平行βシート構造が形成され、そのAβが形成したシート表面とGFPやIGF2R-d11の分子表面に構築したアミロイド様βシート構造がうまく適合して相互作用していることが予想される。今後はそのようなタンパク質とAβの相互作用 メカニズムを明らかにして、Aβ集合化に関する情報を少しでも多く引き出していきたいと考えている。
6.おわりに
以上、筆者らがこれまでに行ってきたアルツハイマー病Aβペプチドを標的とした分子構築について簡単に紹介した。Aβの集合化はアルツハイマー病の発症と密接に関連しており、これを制御することのできる分子構築は、将来的なアルツハイマー病治療に繋がるものであると期待される。筆者らが行ってきた研究は未だ試験管内のレベルにとどまっており、今後はこれまで構築してきた人工分子を使い、モデルマウスなどを用いた生体内でのAβの集合化制御についても検討する必要がある。このようなケミカルバイオロジー的な研究を進めることによって、Aβがどのようにアルツハイマー病の発症と関連しているのかを明らかにし、将来的なアルツハイマー病治療を目指した研究へと進展させていければと考えている。
| 著者紹介 | |
| 氏名 | 高橋 剛(TAKAHASHI TSUYOSHI) |
| 所属 | 東京工業大学大学院生命理工学研究科 生物プロセス専攻 |
| 〒226-8501 神奈川県横浜市緑区長津田町4259-B-40 |
|
| 氏名 | 三原 久和(MIHARA HISAKAZU) |
| 所属 | 東京工業大学大学院生命理工学研究科 生物プロセス専攻 教授 |
| Copyright(c) 1996-2009 DOJINDO LABORATORIES,ALL Rights Reserved. |

