 |
| トップページ > 硫酸転移酵素の持つ多様な生理機能 |
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
硫酸転移酵素の持つ多様な生理機能
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
榊原 陽一(Yoichi Sakakibara) 宮崎大学農学部応用生物科学科 准教授 |
 |
安田 伸(Shin Yasuda) 東海大学農学部バイオサイエンス学科 講師 |
 |
水光 正仁(Masahito Suiko) 宮崎大学農学部応用生物科学科 教授 |
Summary:
In mammals, sulfate conjugation as mediated by the cytosolic sulfotransferases (SULTs) has been shown to be involved in the biotransformation/excretion of xenobiotics as well as endogenous compounds such as steroid hormones and catecholamine neurotransmitters. Based on our recent evidences, it has been clearly demonstrated that sulfation catalyzed by the cytosolic SULTs may play an important role on the detoxification of endocrine disruptors as well as the metabolism of biologically active components, e.g (poly)phenolic compounds, from natural foods. In this review, we summarized the available information regarding the multifunctional role of cytosolic SULTs. Functional implications of the sulfation of harmful oxidated/nitrated products, nitrotyrosine and hydroxylated monoamine compounds, in the pathological settings are discussed.
要約:
生体内における硫酸化は、生体外異物や薬物の解毒代謝機構として、さらにステロイドホルモンや神経伝達物質の濃度調節機構として広く知られている。近年、解毒代謝機構としての内分泌かく乱物質の代謝機構や、食品機能性成分の代謝機構として注目されつつある。さらに、酸化/ニトロ化ストレスの結果生じるニトロチロシンの硫酸化などについて、硫酸転移酵素研究に関する最近の研究動向を紹介する。
Keywords: Sulfotransferase, sulfation, endocrine disruptor, nitrotyrosine, tyrosine nitration
1.はじめに
生体内における硫酸化は、生体外異物や薬物の解毒代謝機構、そしてステロイドホルモンや神経伝達物質であるカテコールアミン類の濃度調節機構として古くから研究されてきた。この様な背景から、硫酸転移酵素は我々の生体内で不必要となった化学物質を体外に排泄する機能を担っていると考えられている1)。近年、筆者らの研究グループをはじめ硫酸転移酵素の研究分野にも積極的に分子生物学的手法が導入された。その結果、従来の酵素学的あるいは生化学的な研究からでは困難な知見が明らかになってきた。分子生物学的手法を導入し、ヒト、マウスおよびゼブラフィッシュをモデル生物として精力的に硫酸転移酵素cDNAのクローニングを行った。その結果、少なくともヒトにおいて11種類、マウスにおいて14種類、ゼブラフィッシュにおいては14種類の硫酸転移酵素遺伝子が存在することを明らかにした2-4)。これらの研究により、同じく解毒代謝機構の酵素として知られるシトクロムP-450酵素群と同様に硫酸転移酵素が、遺伝子スーパーファミリーを形成していることが判明した。現在までの研究により硫酸転移酵素遺伝子スーパーファミリーは、少なくとも5つのファミリーから形成されることが明らかとなった5)。これらの多様な硫酸転移酵素は、最近注目される食品機能性成分(植物性ポリフェノール)や内分泌かく乱物質の代謝にも関与する。さらに、最新の結果より、酸化/ニトロ化ストレスの結果生じるニトロチロシンの代謝へ硫酸化が関与することが明らかとなった。ここでは、筆者らのグループの成果を中心に硫酸転移酵素に関する研究を紹介する。
2.活性硫酸PAPSの合成と硫酸化
生体内における硫酸化に関してまずその反応を簡単に説明する。生体内での硫酸化はまず硫酸の活性化、すなわち1950年代にLipmannらにより発見された哺乳動物に普遍的な硫酸供与体としての活性硫酸PAPS(3'-phosphoadenosine 5'-phosphosulfate)がATPと無機硫酸塩から合成されることが必要である6)。この反応では、生体内においてエネルギー源として大切なATPを2分子消費して1分子の活性硫酸(PAPS)を合成することからも硫酸化がいかに重要か容易に予想される。このPAPS合成には、ATP sulfurylaseとadenosine 5'-phosphosulfate kinase (APS kinase)の二つの酵素反応が関与することが知られている(Fig. 1)。これら二つのPAPS合成に関与する酵素は、大腸菌、カビといった微生物や植物においては二つの異なる酵素タンパク質として存在する。しかし、哺乳動物(ヒト、マウスなど)や昆虫(ショウジョウバエなど)などにおいては二つの酵素が進化の過程で融合し二つの機能を持ったPAPS合成酵素(PAPS synthethase)として存在する。このことから、生物は進化の過程でより効率よくPAPSを合成できるようになってきたと考えられる。1998年に我々はヒトのPAPS合成に関与するPAPS synthethase (Bifunctional ATP sulfurylase/adenosine 5'-phosphosulfate kinase)をクローニングし、大腸菌で発現させることに成功している7)。
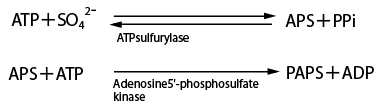
| Fig. 1 |
活性硫酸PAPSの合成 |
このように酵素的に合成された活性硫酸PAPSを用いて、PAPS上の硫酸基を水酸基またはアミノ基に転移する反応が硫酸化でありFig. 2に反応の概要をまとめた。
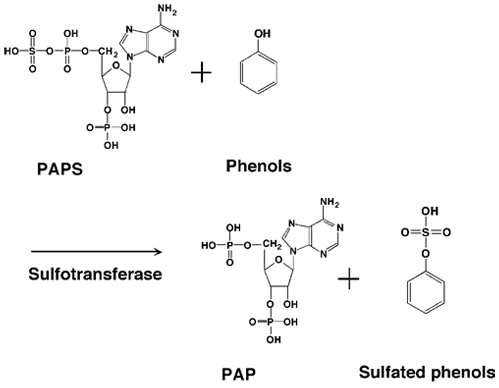
| Fig. 2 |
フェノール性化合物の硫酸化 |
現在、筆者らの研究室では遺伝子工学的に大腸菌で発現したヒトPAPS合成酵素を用いて硫酸転移酵素研究に不可欠な[35S]-放射活性ラベルした活性硫酸PAPSを酵素的に合成している。さらに同じく大腸菌で発現したリコンビナントヒト硫酸転移酵素を調製し、これらを用いて研究している。今後の応用の可能性として、リコンビナント硫酸転移酵素を利用することで、有機化学的な合成では難しい様々な化学物質の硫酸体の調製が、酵素的に合成(硫酸化)可能となり様々な分野に利用できると考えている。
3.硫酸転移酵素遺伝子ファミリー
硫酸転移酵素に関する研究は1980年代までは臓器由来の酵素タンパク質を扱う生化学的な研究が中心であった。1997年当時の硫酸転移酵素に関する総説においてでさえ、ヒトにおける硫酸転移酵素はフェノール硫酸転移酵素2種、ヒドロキシステロイド硫酸転移酵素1種、エストロゲン硫酸転移酵素1種の合計4種の酵素の存在が知られているにすぎなかった8)。1990年代後半にはヒト、マウス、ラットを始め様々な動物種において硫酸転移酵素のクローニングが盛んに行われ新規の硫酸転移酵素が多数発見された。筆者らの研究も含めて、現在までに少なくともヒトで11種類、マウスにおいて14種類、ゼブラフィッシュにおいて14種類の硫酸転移酵素が存在しシトクロムP-450同様に硫酸転移酵素も遺伝子スーパーファミリーを形成していることが判明した(Fig. 3)2-4)。

| Fig. 3 |
ヒトおよびマウス硫酸転移酵素遺伝子ファミリーの分子系統樹 |
現在、硫酸転移酵素の分類に関しては硫酸転移酵素ワークショップにおいて提唱された分類法によりアミノ酸配列をもとに分類することが推奨されている8)。分類法としては、硫酸転移酵素はSULTという略号を用いて、その後にファミリーを表す数字を付ける。例えば、SULT1はフェノール硫酸転移酵素ファミリー、SULT2はヒドロキシステロイド硫酸転移酵素ファミリーというように分類される。さらにこれらのファミリーごとにアミノ酸配列が60%以上一致するグループをサブファミリーとし、アルファベットをAから順に付けていく。その結果、例えばヒトP型フェノール硫酸転移酵素の場合は生化学的な解析のみでは判らなかった異なる遺伝子にコードされた酵素が二種存在するためにSULT1A1、SULT1A2の二種が存在し、ヒトM型硫酸転移酵素の場合はSULT1A3となる。以下はこの硫酸転移酵素分類法に基づく分類名を用いることとする。
筆者らの研究グループによる最近の研究により、マウスにはSULT3A1とSULT3A2の2種類のSULT3ファミリー硫酸転移酵素が存在することが明らかになった9)。このSULT3ファミリー硫酸転移酵素は、ナフチルアミンなど芳香族アミンのアミノ基を特異的に硫酸化するユニークな性質の硫酸転移酵素である。マウスでは2つの機能的なSULT3硫酸転移酵素遺伝子を持つのに対し、ヒトゲノム上には機能的なSULT3硫酸転移酵素遺伝子が見いだせない。よって、ヒトにおいて芳香族アミンの硫酸化に関与する酵素がこれとは別に存在している可能性が考えられる。また、ヒトゲノム上には4つのSULT1A硫酸転移酵素遺伝子(1A1〜1A4)が存在するのに対し、マウスゲノムには1つSULT1A1しか存在しない。このように、硫酸転移酵素遺伝子スーパーファミリーはゲノム上で重複等によってコピー数が増加することで多様になってきたと考えられるが、ヒトとマウスの種間では一部にそのゲノム構造に大きな違いが見られる。このことは、今後の硫酸転移酵素研究において種間で機能的に相補している硫酸転移酵素を特定することの難しさを示唆するものである。
4.内分泌かく乱物質(環境ホルモン)と硫酸化
近年、女性ホルモンであるエストロゲン様のホルモン作用(Fig. 4中の )あるいは男性ホルモン作用をかく乱する環境中の化学物質すなわち「内分泌かく乱物質」(環境ホルモン)の危険性が報告されている。一般に「環境ホルモン」は生体内に取り込まれると蓄積し、最終的に内分泌系の異常を誘発するといった悪いイメージが持たれている。これまでに述べてきたように硫酸化は親油性の化合物に硫酸基という親水性の高い官能基を導入することで尿中への排泄を促す解毒代謝機構である。
)あるいは男性ホルモン作用をかく乱する環境中の化学物質すなわち「内分泌かく乱物質」(環境ホルモン)の危険性が報告されている。一般に「環境ホルモン」は生体内に取り込まれると蓄積し、最終的に内分泌系の異常を誘発するといった悪いイメージが持たれている。これまでに述べてきたように硫酸化は親油性の化合物に硫酸基という親水性の高い官能基を導入することで尿中への排泄を促す解毒代謝機構である。
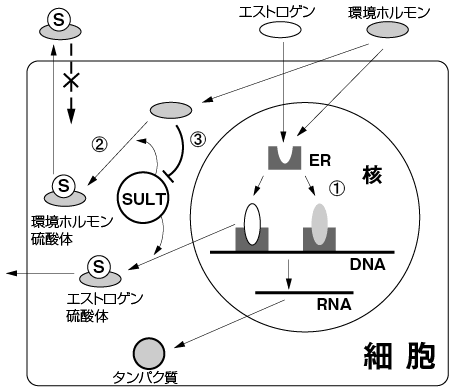
| Fig. 4 |
内分泌かく乱物質(環境ホルモン)の作用メカニズムおよびその硫酸化 |
これらのことより、ヒドロキシル基またはアミノ基を持つ「環境ホルモン」の生体内代謝における硫酸化の関与は、ホルモン制御に大きく影響していることが推察された。筆者らの研究グループは、7種のヒトの硫酸転移酵素によるビスフェノールA、アルキルフェノール、ジエチルスチルベステロール(DES)そしてエチニルエストラジオール等の環境ホルモン候補物質に対する硫酸化を検討し報告した(Fig. 4中の )。
)。
その結果より、これらの環境ホルモン候補物質は全てヒト硫酸転移酵素の基質となりうることが明らかになった。この研究では、試験した7種のヒト硫酸転移酵素がそれぞれの環境ホルモンに対して異なった基質特異性を示した(Table 1)。これらの酵素は生体内で臓器特異的に発現調節がなされている酵素も多く、環境ホルモンの種類によってはその影響を受けやすい臓器の存在が示唆された10)。
さらに、筆者らの研究グループは内分泌かく乱物質(環境ホルモン)として知られるトリブチルスズなど有機スズが、エストロゲン硫酸転移酵素SULT1E1活性を阻害することを見いだした11)。このことは、トリブチルスズをはじめ多くの内分泌かく乱物質が持つエストロゲン様作用メカニズムの一つとしてエストロゲンの濃度調節機構としての硫酸化に影響することを示している(Fig. 4中の )12)。
)12)。
| SULT1A1 | SULT1A3 | SULT1B1 | SULT1C2 | SULT1C4 | SULT1E1 | SULT2A1 | |
|---|---|---|---|---|---|---|---|
| Bisphenol A | 965±206 | N.D. | 3.9±0.2 | N.D. | 173±12 | 51.9±11.0 | 19.9±3.5 |
| 4-Octylphenol | 1920±152 | 675±81 | 17.1±8.7 | N.D. | 1920±103 | 475±34 | 18.3±5.8 |
| p-Nonylphenol | 1969±117 | 39.7±1.7 | 52.7±4.3 | N.D. | 268±63 | 221±18 | 39.9±12.2 |
| Diethylstilbestrol | 1538±233 | 19.0±7.9 | 3.2±0.1 | N.D. | 296±45 | 188±27 | 11.3±7.1 |
| 17a-Ethynylestradiol | 1200±79 | N.D. | 1.6±0.1 | N.D. | N.D. | 243±57 | 26.9±10.1 |
N.D.:Activity not detected.
5.酸化/ニトロ化ストレスと硫酸化
今から遡ること約15年前、筆者らの研究グループは生命現象として生体内で生じる遊離チロシン硫酸体の起源を探っていた。そしてHepG2ヒト肝腫瘍細胞などを用いて、遊離チロシンやドーパなどの硫酸化が培養細胞レベルで起こることを見いだし、またこれらモノアミン系化合物の硫酸化はヒトSULT1A3(別名:M型フェノール硫酸転移酵素、またはカテコールアミン型フェノール硫酸転移酵素)によって触媒されることを世界に先駆けて明らかにした13,14)。SULT1A3がチロシンとよく似た構造を有する様々なモノアミン系化合物の活性調節を担うこともあいまって、筆者らの関心は本酵素が有する多面的な機能の解明、とくに疾病リスクに対する生体防御機構としてのSULT1A3の機能に関する研究へと次第に向かっていった。
5. 1 ニトロチロシン
過度の酸化/ニトロ化ストレスにより生じた一酸化窒素由来の反応性窒素酸化物ペルオキシナイトライトは、生体内における遊離アミノ酸あるいはタンパク質アミノ酸残基としてのチロシンを容易にニトロ化することが知られている。その反応産物であるニトロチロシンは、動脈硬化症、脳卒中、肺疾患、肝炎、および慢性リウマチをはじめ様々な病態において検出されており、体内での酸化/ニトロ化ストレス状態とこれらストレスに惹起されうる疾患とのリスク関係を知る上で有効なバイオマーカーとして広く認知されている。最近の研究では、とくに遊離型のニトロチロシンがDNAの酸化損傷を引き起こし、培養細胞レベルでアポトーシスを誘導すること、そしてマウス脳内では神経変性を引き起こして正常な神経伝達を阻害することが明らかとなっており、ニトロチロシンもまた疾病リスク因子であることが提唱されるようになってきた。一方、生体内での硫酸化の機能は、(i) 生体外異物の解毒代謝としての硫酸化、(ii) ホルモンなどの生体内内因性物質の濃度調節機構の2つがこれまで主軸として考えられてきた。そこで筆者らは、「我々の体もまたリスク因子としてのニトロチロシンを代謝変換により濃度調節あるいは除去するメカニズムが備わっているのでは?」と考え、硫酸化がその役割を担う可能性について検証することとした。
5. 2 ニトロチロシン硫酸体の発見とSULT1A3
まず筆者らは、遊離型ニトロチロシン存在下でHepG2細胞および[35S]-放射活性硫酸を用いた代謝ラベル実験を行った。その結果、培地中に添加された遊離ニトロチロシンが培養細胞内に取り込まれ、硫酸化による代謝調節を受けて[35S]-ニトロチロシン硫酸体として培地中に放出されることが初めて明らかになった15)。さらに、酸化/ニトロ化ストレス研究に用いられる SIN-1 (3-morpholinosydnonimine)をペルオキシナイトライト供給剤として代謝ラベル実験を行ったところ、[35S]ニトロチロシン硫酸体が細胞より産生されて培地中へ放出されることが認められた15)。興味深いことに、ニトロチロシンの硫酸化はHepG2細胞のみでなく、他のヒト由来初代内皮培養細胞(HUVEC、HPAECおよびHLMVEC)、肺上皮細胞(H441およびBEAS-2B)、および乳腺上皮細胞(MCF-7およびMCF 10A)においても同様に観察された 16)。このことは、ニトロチロシン硫酸化が、多様な臓器由来の細胞種において一般的に起こりうること、そしてニトロチロシンが代謝変換されることを示唆するものであった。さらに[3H]-チロシンを用いた代謝ラベル実験を行ったところ、SIN-1処理後に産生された多くの[3H]-ニトロチロシン(90.4-94.8%)が非抱合体としてHepG2細胞内で検出され、培地中には多くの硫酸化された[3H]-ニトロチロシン(23.2-59.2%)が時間依存的に放出されることを明らかにした15)。これらの結果は、酸化/ニトロ化ストレスによって生じた遊離ニトロチロシンの細胞内代謝調節には硫酸化が機能しうることを意味するものであった。しかしながら、これまで安定な最終産物またはバイオマーカーとして認識されてきた遊離ニトロチロシンがどのように抱合体として生成するのか、さらにグルクロン酸抱合化などの他の代謝経路の存在については未だ全容解明には至っていない。
これまでに我々は、ヒト硫酸転移酵素について大腸菌を用いたリコンビナント酵素の大量精製を行ってきており、すでに既知の11種類の硫酸転移酵素のコレクションを有している。そこで、これら11種類のうちニトロチロシンを硫酸化する酵素の特定を試みたところ、SULT1A3のみで有意な活性が認められ、同濃度100μMのチロシンを基質としたときよりも高い比活性値(2.11 nmol/min/mg enzyme vs. 0.01 nmol/min/mg enzyme)が得られた15)。さらにニトロチロシンはSULT1A3による遊離チロシンの硫酸化を競争的に阻害することも判明した15)。一方で、ヒトの体内では95%以上のドーパミンや70%程度のノルエピネフィリンといったモノアミン系化合物が硫酸抱合体として血中を循環していることが報告されており、生体内のカテコールアミン類の恒常性や生体外モノアミン類の代謝変換にはSULT1A3が重要なはたらきを担っていると考えられている。これまでの筆者らの研究結果により、SULT1A3がドーパミンだけでなく、遊離チロシンやその異性体、そしてドーパなどのモノアミン系化合物に対しても有意に硫酸化活性を示すことが判明している14)。今回明らかとなったニトロチロシンの硫酸化を含めると、SULT1A3は非常に多面的な生理機能を有すること(cf. Fig. 516))、そして酸化/ニトロ化ストレスによって生じるリスク因子としてのニトロチロシンに対して防御的に機能しうることが示唆された。遊離ニトロチロシン硫酸体は、タンパク質中のニトロ化チロシンの分解を経由して生じることなどが考えられるが、その生成経路についての詳細な検討も必要である。今後、in vivoにおける遊離ニトロチロシンおよびその硫酸抱合体あるいは代謝物の体内レベルを評価することが酸化/ニトロ化ストレスを介した疾病状態を予知する上で重要であり、これらもまた有効なバイオマーカーとして利用されることが予想される。
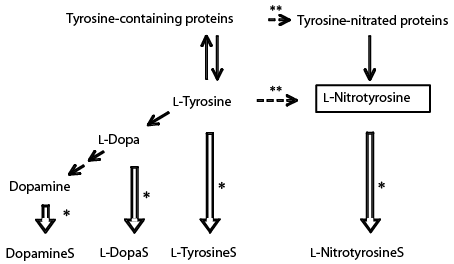
| Fig. 5 |
ヒトSULT1A3によるチロシンおよび関連化合物の硫酸化 |
6.神経疾患リスクと硫酸化
近年、医療技術の向上および衛生面など生活環境の改善によって我々の寿命は伸びてきており、わが国をはじめ先進国ではすでに高齢化社会を迎えつつある。それに付随して注目されてきた疾病のひとつにアルツハイマー病やパーキンソン病などの神経疾患が挙げられるが、これまで原因究明と治療法の確立に関する研究に重点が置かれてきた。その発症の原因としてセロトニンやドーパミンなどを介した神経伝達の異常や過度の酸化ストレスなどが考えられているが、これら疾病リスクに対する防御機構については明らかにはなっていない。一方で、酸化ストレス下で生じうる7-ヒドロキシセロトニンや6-ヒドロキシドーパミンといったモノアミン系の酸化型神経伝達物質が神経細胞の損傷を引き起こすことが報告されており、筆者らは硫酸化の視点よりSK-N-MCヒト神経芽腫細胞を用いてこれらの疾病リスク因子に対する防御機構について調べることとした。
6. 1 7-ヒドロキシセロトニンと6-ヒドロキシドーパミン
我々の体内では、セロトニンとドーパミンはよく知られたモノアミン系神経伝達物質であり、これらはセロトニンまたはドーパミン作動性レセプター特異的な神経伝達の調節を行うことにより、感情や記憶などの精神状態や物理的行動を制御すると考えられている。これら化合物もまた硫酸抱合化により代謝調節され、体内では血液、尿および脳髄液内に硫酸体として存在することが報告されている。近年の研究により、セロトニンやドーパミンに水酸基が付与された酸化型産物7-ヒドロキシセロトニン(5,7-ジヒドロキシトリプタミン)および6-ヒドロキシドーパミンが、ヒドロキシルラジカルを介した酸化反応により生じうること、酸化ストレスとともにこれらが神経細胞に損傷を与えることでアルツハイマー病やパーキンソン病などの神経疾患を惹起することが提唱されている。そこで筆者らは、「7-ヒドロキシセロトニンや6-ヒドロキシドーパミンなどの有害なモノアミン系化合物による神経疾患リスクに対して、我々の体もまた防御機構が備わっている」と考え、前章と同様のアプローチを用いて硫酸化がその役割を担う可能性について検証することとした。
6. 2 7-ヒドロキシセロトニンおよび6-ヒドロキシドーパミンの硫酸化とSULT1A3
既知の11種類のヒト由来SULTsを用いて、7-ヒドロキシセロトニンおよび6-ヒドロキシドーパミンを硫酸化する酵素の特定を試みた結果、SULT1A3がこれら酸化型物質を硫酸化する主酵素であること、続いてSULT1C#2およびSULT1A1もまた低い活性ながらこれらの基質を硫酸化しうることが明らかとなった17)。さらに7-ヒドロキシセロトニンはSULT1A3によるセロトニンの硫酸化を競争的に阻害し、6-ヒドロキシドーパミンもまたドーパミンの硫酸化を同様に阻害することも判明した17)。このことより、これら酸化型モノアミン系化合物は硫酸化により代謝変換されるものの、同時にセロトニンやドーパミンの硫酸化による代謝調節にも影響を与える可能性が考えられた。つぎに筆者らは、7-ヒドロキシセロトニンまたは6-ヒドロキシドーパミンとともにSK-N-MC細胞および放射線標識硫酸[35S]を用いた代謝ラベル実験を行った。その結果、培地中に添加された7-ヒドロキシセロトニンは培養細胞内に取り込まれ、硫酸化による代謝調節を受けて7-ヒドロキシセロトニン[35S]硫酸体として培地中に放出されることが明らかになった17)。興味深いことに6-ヒドロキシドーパミンの場合、6-ヒドロキシドーパミン[35S]硫酸体に加えて6-ヒドロキシドーパミン由来の[35S]硫酸体がいくつも検出された。さらに阻害剤を用いた試験により、これら6-ヒドロキシドーパミン由来硫酸体のいくつかはカテコール O-メチル基転移酵素およびモノアミンオキシダーゼなどの酵素による代謝変換および硫酸転移酵素による硫酸化を経て細胞外へ産出されていることがわかった17)。この結果は、ドーパミンが硫酸化だけでなくメチル化やモノアミン酸化など複数の酵素のはたらきによって代謝変換されうるというこれまでの報告と一致している。つぎに、これら化合物の硫酸化反応にはSULT1A3が関わっているかどうかを調べるため、SULT1A3特異的なsiRNAを用いてSK-N-MC細胞内のSULT1A3レベルを人為的に低減させる実験を行った。その結果、細胞抽出液による7-ヒドロキシセロトニンと6-ヒドロキシドーパミンの硫酸化活性は有意に低下したことから、これら酸化型モノアミンは主に細胞内のSULT1A3によって硫酸化されることが明らかとなった。
これらの結果より、7-ヒドロキシセロトニンや6-ヒドロキシドーパミンといった有害なモノアミン系化合物が神経細胞内で代謝変換され、そこでもSULT1A3による硫酸化が積極的に機能していることが判明した。一方、6-ヒドロキシドーパミン硫酸体については他の代謝経路の存在も示唆され、疾病リスク因子となりうる化合物によってはSULT1A3だけでなく複数酵素による防御機構が細胞内に備わっていることが窺えた。
7.おわりに
以上述べてきたように、生体内における硫酸化は、単に生体外異物の解毒代謝および体内物質の濃度および活性調節を行うだけでなく、エストロゲン代謝阻害を介した環境中内分泌かく乱物質の活性発現メカニズムの標的となりうること、さらに疾病環境における酸化/ニトロ化ストレスの結果生じるニトロチロシンなど有害な酸化物もしくはニトロ化物に対して生体防御的に働きうることが次々に明らかになってきた。しかしながら、我々身体の恒常性を維持するその多様な生理機能の解明にはまだまだ未開拓の余地があるのかもしれない。
筆者らのグループは、これまでにマウス由来のある種のSULTがプロスタグランジンやロイコトリエンといった炎症反応のメディエーターとなるエイコサノイド類を硫酸化することが、炎症応答の沈静化にも機能しうることを見出している18)。今後ヒトSULT1A3をはじめ各種硫酸転移酵素が有する多面的な生理機能と疾病環境における機能について明らかにされることが期待される。
謝辞
本研究を行うにあたり終始ご指導とご協力をいただき、そして現在も共同で硫酸転移酵素の機能解明に向けた研究を実施している米国トレド大学薬学部Ming-Cheh Liu博士に心よりお礼申し上げます。また、研究にご協力いただきました、宮崎大学医学部の中山建男教授と高見恭成准教授、愛媛大学農学部の菅原卓也准教授にお礼申し上げます。
本研究は厚生労働科学研究費「萌芽的先端医療技術推進研究事業(トキシコゲノミクス)」、文部科学研究費「基盤研究B、若手研究B」および科学技術振興機構の地域結集型共同研究事業の支援により遂行されています。
| 著者紹介 | |
| 氏名 | 榊原 陽一(Yoichi Sakakibara) |
| 所属 | 宮崎大学農学部応用生物科学科 准教授 |
| 住所 | 〒889-2192 宮崎市学園木花台西1-1 |
| 電話 | 0985-58-7211 |
| Fax | 0985-58-7211 |
| ysakaki@cc.miyazaki-u.ac.jp | |
| 出身大学 | 宮崎大学農学部農業化学科 |
| 学位 | 博士(農学)鹿児島大学 |
| 現在の研究テーマ | 翻訳後修飾としてのチロシン硫酸化の機能解明、プロテオーム解析による食品機能性評価 |
| 氏名 | 安田 伸(Shin Yasuda) |
| 所属 | 東海大学農学部バイオサイエンス学科 講師 |
| 住所 | 〒869-1404 熊本県阿蘇郡南阿蘇村河陽 東海大学農学部 |
| 電話 | 0967-67-3946 |
| Fax | 0967-67-3960 |
| shin.yasuda@agri.u-tokai.ac.jp | |
| 出身大学 | 九州大学大学院生物資源環境科学府 生物機能科学専攻食糧科学 |
| 学位 | 博士(農学) |
| 現在の研究テーマ | 食品素材の機能性に関する研究 生理活性物質の機能性と代謝調節に関する研究 |
| 氏名 | 水光 正仁(Masahito Suiko) |
| 所属 | 宮崎大学農学部応用生物科学科 教授 |
| 住所 | 〒889-2192 宮崎市学園木花台西1-1 |
| 電話 | 0985-58-7215 |
| Fax | 0985-58-7215 |
| msuiko@cc.miyazaki-u.ac.jp | |
| 出身大学 | 九州大学農学部農芸化学科 |
| 学位 | 農学博士 九州大学 |
| 現在の研究テーマ | 細胞質硫酸転移酵素の網羅的機能解析、翻訳後修飾としてのチロシン硫酸化の機能解明、ハイスループット食品機能性評価法の開発 |
| Copyright(c) 1996-2009 DOJINDO LABORATORIES,ALL Rights Reserved. |