|
| トップページ > エイズから見た感染症研究の最前線 |
 |
||||||
エイズから見た感染症研究の最前線 −最終回−
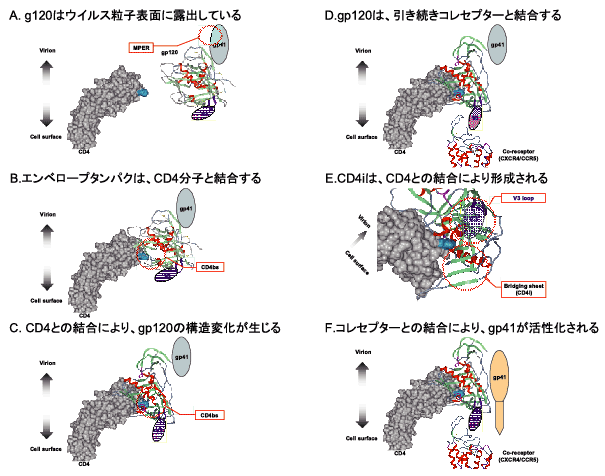
1.はじめにヒト免疫不全ウイルス(Human Immunodeficiency Virus type-1; HIV-1)は、主にCD4陽性の単球、マクロファージおよびCD4陽性Tリンパ球に感染し、直接的あるいは間接的にこれらの細胞を傷害し、後天性免疫不全症候群(Aquired Immunodeficiency Syndrome; AIDS)を引き起こす。 HIV-1感染に対する免疫応答のひとつとして、多くのウイルス感染症と同様に、HIV-1特異的な抗体が誘導される。これらの抗体の有無は、HIV-1感染症において、診断の指標の一つとして利用されている。それらの抗体には、HIV-1のウイルス粒子と結合し、標的細胞への感染を阻止することができる抗体(中和抗体; neutralizing antibody)が含まれている。HIV-1特異的な中和抗体は、ウイルス粒子の表面に存在するエンベロープタンパクに結合し、標的細胞への侵入を様々な段階で阻害することで、感染を阻止することが知られている。 本連載の第5回、抗HIV剤開発で詳述されているように、HIV-1に対する様々な化学療法剤が実用化されており、適切な治療を受けることで、AIDSの発症を阻止することができるようになった。しかし、世界的に見て、そのような治療を受けることができる感染者はごく一部であり、また、潜伏感染しているウイルスのため、多くのウイルス感染症と異なり、治療を行っても“治癒”はきわめて困難であると考えられている。そのため、感染の拡大を阻止することができるワクチンの、早急な開発が求められている。HIV-1に対するワクチン開発においては、HIV-1特異的な細胞性免疫とともに、液性免疫、特にHIV-1の感染を阻止しうる中和抗体を誘導することが重要な目標である。今回は、HIV-1に対する中和抗体と、その標的となるウイルスエンベロープタンパクの構造解析に関する最近の知見を通して、ワクチンの開発に対する取り組みを紹介したい。 2.HIV-1エンベロープタンパクの構造と抗原認識部位HIV-1のウイルス粒子は、感染細胞に由来する脂質二重層で被膜され、その表面にエンベロープタンパクを持つ。HIV-1に対する中和抗体は、一般にエンベロープタンパクを認識し、ウイルス粒子表面に結合することでHIV-1の感染を阻害すると考えられている。HIV-1のエンベロープタンパクは、160kDaの糖化タンパクであるgp160として感染細胞内で合成され、細胞由来のプロテアーゼにより、gp120およびgp41に切断される。これらのタンパクは、非共有結合により緩やかに結合し、1つのgp120と1つのgp41からなるエンベロープタンパク単量体(monomer)を形成する。さらに、golgi体において、エンベロープタンパク単量体は、非共有結合による緩やかな結合により、3量体(trimer)となり、細胞膜表面に輸送される。細胞表面に輸送されたエンベロープタンパク3量体は、ウイルス粒子に取り込まれ、出芽(budding)する。ウイルス粒子上では、gp120はウイルス表面側に位置している。gp41は膜貫通部位を持ち、エンベロープタンパクをウイルス粒子の脂質二重層上に保持している。 HIV-1の標的細胞への感染は、標的細胞表面のレセプターであるCD4、およびコレセプターであるCXCR4またはCCR5とエンベロープタンパクが結合し、標的細胞とウイルス粒子が膜融合を生じることで成立する(Fig. 1)。CD4は、ウイルス粒子上のgp120のCD4結合部位(CD4 binding site; CD4bs)と結合し、gp120の立体構造変化を引き起こす。その結果、コレセプターとgp120との結合部位の一部を構成する、4つのβ-strandからなるbridging sheetが形成される。この部位は、CD4との結合の結果形成されるため、CD4i(CD4 induced epitope)と呼ばれる。また、gp120上には5ヶ所の比較的変異に富む部位(Variable loop 1〜5; V1〜V5)が存在するが、その中のV3 loopは、bridging sheetと同様に、コレセプターとの結合に重要な役割を果たしている。コレセプターとの結合により、エンベロープタンパクにはさらなる立体構造変化が生じ、gp41のN端部分に存在するfusion peptideが活性化され、標的細胞との膜融合が生じる。
従来、ウイルスエンベロープの立体構造は、精製された単量体のgp120単独、あるいはgp120とCD4分子、およびCD4iに対する抗体を結合させた状態でのX線結晶解析により同定されてきた。しかし、ウイルスエンベロープタンパクの単量体は、熱力学的な解析により、ウイルス粒子表面の3量体とは異なる立体構造を持つことが示唆されている。中和抗体は、ウイルス粒子上のエンベロープタンパク3量体をその標的としており、その立体構造の解析は、中和抗体の結合様式の理解、そしてそのような中和抗体を誘導するワクチンを開発する上で、きわめて重要であると考えられる。近年、cryo-EMとelectron-tomography法を用い、ウイルス粒子表面に存在するエンベロープの立体構造を可視化することに、複数のグループが成功している。これらにより、3量体構造の概要、CD4との結合によるエンベロープタンパクの立体構造変化の様式、中和抗体とエンベロープタンパクとの結合様式などに重要な知見が得られている。しかし、技術的な問題により、X線結晶解析に比べると低解像度であり、また、解析に用いた材料、手法の違いが影響していると考えられるが、各グループで得られたエンベロープタンパク3量体の構造は、それぞれ異なる特徴を持ち、類似性に乏しい部分が存在する。そのため、エンベロープタンパク3量体の構造を明らかにするためには、より精密な解析が必要とされている。 3.HIV-1に対する中和抗体HIV-1感染者においても、他のウイルス感染症同様、HIV-1特異的な中和抗体が産生される。しかし、HIV-1は、ウイルス自身の逆転写酵素の特性上、高率に突然変異が生じること、また、ウイルス間での遺伝子組み換えが生じることなどのために、中和抗体に耐性を持つウイルスが、比較的速やかに選択される。そのため、多くの感染者で誘導される中和抗体は、抗体が検出された時点より数か月前に存在したHIV-1に対しては中和活性を示すものの、抗体が検出された時点のウイルスは中和できないものである。その結果、多くの感染者では、特異的な中和抗体が産生されているにもかかわらず、ウイルスの増殖を抑制し、排除することができない。 いままでに、感染者の骨髄細胞などを元に作成されたファージディスプレイライブラリーや、末梢血B細胞由来のハイブリドーマ細胞を用い、様々な中和抗体が精製されている。それらの多くは、上記の通り、ある特定のHIV-1は中和できるものの、異なるアミノ酸配列を持つHIV-1は中和できない、型特異的なものであった。その一方、少数ではあるが、HIV-1感染者より、広範なHIV-1を中和できる抗体が分離されている(Table1)。そのような中和抗体の抗原認識部位(epitope)は、CD4bs、V3 loop、CD4iに加え、gp120表面の糖鎖、およびgp41の膜貫通部位近傍(membrane proximal external region; MPER)の5ヶ所に存在する。 Table1 広範なウイルスに対する中和抗体 
4.HIV-1に対するワクチン開発の現状と問題点現在有効性の確認されているウイルス感染症に対するワクチンは、主にウイルスに対する中和抗体を誘導することでウイルスの感染を阻止すると考えられている。表1にあげられたような、広範なHIV-1を中和できる抗体を受動免疫することで、ウイルスの新規感染を、個体レベルで阻止しうることが明らかとなり、これらと類似した活性を持つ抗体を誘導することで、HIV-1の感染を阻止しうる可能性が示唆された。そのため、当初は中和抗体を誘導することを主眼においた開発が行われた。しかし、現在のところ、十分な活性を持つ中和抗体を誘導する方法は発見されていない。世界で最初のHIV-1に対するワクチンであるAIDSVAXは、1999年より第3相臨床試験が開始された。これは、精製したgp120を抗原として使用し、主にエンベロープタンパクを認識する中和抗体を誘導することを目的とするものであったが、2003年に、ワクチンとしての有効性がみられないことが明らかとなった。その要因のひとつとして、表1にあげられたような、広範なウイルスを中和できる抗体の特殊性があげられる。CD4bsを認識するb12のエピトープは、エンベロープタンパクの立体構造に依存した、gp120上の非連続的な領域から構成されている。そのため、ペプチドあるいは単量体のエンベロープタンパクを用いた免疫では、誘導することができない。17bは、CD4iを認識するが、このエピトープは、gp120とCD4が結合した結果生じる立体構造変化により形成され、ウイルス粒子と標的細胞膜がきわめて近接した状態でしか存在しない。そのため、Fc部分を含む完全長の抗体は、物理的障害のためにエピトープにアクセスすることができないことが知られている。また、2G12は糖鎖を認識する極めてまれな抗体であるが、そのような抗体を誘導する方法は確立されていない。MPERを認識する2F5、4E10のエピトープは、gp41上の連続した領域に存在するが、エピトープと同一の配列を持つペプチドの免疫では、類似した活性を持つ中和抗体は誘導されなかった。これらの抗体は、カルジオリピンなどの自己抗原と交差反応を示すことが知られており、ヒトにおいては誘導が困難である可能性が指摘されている。これらの抗体と異なり、V3 loopの持つ高い抗原性のために、特定のV3 loopをエピトープとする中和抗体は、比較的容易に誘導することができる。しかし、そのようにして得てられた抗体は、一般に、免疫に用いたV3 loopと異なるアミノ酸配列を持つV3 loopに対しては中和活性を示さない、型特異的なものである。 そこで、ワクチン開発の主眼はHIV-1特異的な細胞性免疫を誘導することに重きが置かれるようになった。2004年より、主にHIV-1特異的な細胞性免疫を誘導することを目標に、HIV-1の遺伝子の一部を含むアデノウイルスベクターを用いた、2つのHIV-1ワクチンの臨床試験(STEP study、Phanbili study)が開始された。しかし、これらの臨床試験では、ワクチン投与群の方が、プラセボ投与群よりもウイルス感染の頻度が高い傾向が見られたとして、2007年に相次いで中止されている。 現在、HIV-1に対するワクチン開発において、世界的にその方向性が再検討されている。その一つは、中和抗体の重要性が再認識されつつあることである。広範なウイルスを中和できる抗体の誘導法開発を目標に、ウイルスエンベロープ3量体の詳細な立体構造解析、立体構造に基づいた抗原の設計、DNAワクチン、プロテインブーストなど、より誘導能の高い免疫法の開発、新規アジュバント開発などが精力的に行われている。 5.おわりにHIV-1の持つ多様性のため、有効なワクチン開発は困難を極めている。しかし、HIV-1感染症は治癒が困難であること、感染者が増え続けていることなどから、その必要性はますます増している。現状を打開し、ワクチン開発を進めるためには、既存の方法にとらわれない、新たな視点、方法が求められている。そのためには、ウイルス学のみならず、免疫学、立体構造学など、研究領域を超えた協力が重要であることは明らかである。本連載が、その一助となることを期待したい。
|
| Copyright(c)1996-2008 DOJINDO LABORATORIES,ALL Rights Reserved. |