 |
| トップページ > オキシダーゼとデヒドロゲナーゼのフラビン学 |
 |
||||||||||||||||||||||||||||||||||
オキシダーゼとデヒドロゲナーゼのフラビン学
|
||||||||||||||||||||||||||||||||||
 |
三浦 洌 株式会社同仁化学研究所 |
[SYNOPSIS]
Flavooxidases, i.e., flavin-dependent oxidases, and flavodehydrogenases, i.e., flavin-dependent dehydrogenases, differ from each other in their oxidative-half reaction. The former use molecular oxygen as oxidant, while the latter utilize other types of oxidant than oxygen. The reactivity of reduced flavin to oxygen is crucially different between these types of flavoenzymes, in accordance with their individual physiological roles. The molecular strategy that each type of enzymes deploys in regulating the reactivity toward molecular oxygen in the oxidative half-reaction is discussed on the bases of chemical as well as structural aspects of flavooxidases and flavodehydrogenases.
1.はじめに
標題にあるフラビン学(Flavonology)は造語で、化学や生化学、医学関連の辞書、教科書には掲載されていない言葉である。Flavonologyとは、フラビンを研究対象にする化学者や生物化学者が自らの研究領域を指してよく使われる言葉で、要するに、フラビンの化学と生化学、酵素化学などをひっくるめた領域を指している。Flavonologyの直訳がフラビン学ということになる。(フラボ(flavo)はフラビンを表す接頭語である。紛らわしいが、植物成分のフラボン(flavone)はフラビン(flavin)とはまったく別の分子種である。)本稿では、筆者が平成20年3月まで所属していた熊本大学大学院医学薬学研究部分子酵素化学分野において行った研究に基づいて、オキシダーゼとデヒドロゲナーゼのフラビン学を概説したい。
フラビンとは、イソアロキサジン骨格を持った化合物の総称であるが、一般にフラビン分子種といえば、リボフラビン、FMN (flavin mononucleotide)、FAD (flavin adenine dinucleotide)を指す(Fig. 1)。ただし、厳密に言えば、FMNもFADもヌクレオチドではない。フラビンのもっとも重要な生理的機能は、補酵素としてのそれであるが、フラビンの補酵素型はFMNとFADで、リボフラビン(ビタミンB2)には補酵素作用はないと言われている。FMNまたはFADを補酵素とする酵素群は、フラビン酵素(flavoenzyme)と称され、通常は酸化還元反応を触媒するが、酸化還元反応以外の反応を触媒するフラビン酵素もごく例外的に知られている。酵素タンパク質に結合して酵素固有の触媒作用を担う補酵素は、基質型と触媒型に大別されるが、FMN, FADは後者に属する。(前者の代表的なものはピリジンヌクレオチド補酵素(NAD(P)+,NAD(P)H)である。)触媒型補酵素には、フラビンの他にピリドキサルリン酸、チアミンピロリン酸、葉酸、ビオチン、コバラミンなど、多くのビタミン(誘導体)が知られているが、フラビン補酵素は、その触媒する反応の種類、基質の種類のいずれにおいても、その多様性は触媒型補酵素の中で群を抜いている。その理由は、フラビン分子の構造とそれに基づく反応性にあることは言うまでもない。Fig. 2に示すように、フラビンには三つの酸化還元状態(酸化型、セミキノン型(1電子還元型)、還元型(2電子還元型))と三つのイオン化状態(陽イオン型、中性型、陰イオン型)があり、pKa値から判断して少なくとも6種類の状態が生理的には可能である。これらの状態はそれぞれ固有の化学的特性を示すが、それが酵素タンパク質に結合することで、その酵素に特有の触媒機能が発揮される。フラビンには、酸化型・セミキノン型・還元型の三つの酸化還元状態が可能であることから、フラビン補酵素は、1電子過程と2電子過程のいずれにも関与することができる。したがって、1電子過程と2電子過程が混在する反応には、必ずと言ってよいほどフラビン酵素が関与する。たとえば、フラビン酵素のNADPHシトクロムP450レダクターゼは、NADPHから2電子を受け取り、シトクロムP450のヘム鉄に1電子を2回供給する。さらに、フラビンは高い光感受性を示し、それを利用した光増感作用を示すフラビン酵素も知られている。たとえば、損傷DNAを光増感的に修復するDNAホトリアーゼはフラビン酵素である。また基質との反応によって励起されたフラビンが発光するのが、発光細菌の細菌ルシフェラーゼで、FMNを補酵素とするフラビン酵素である。
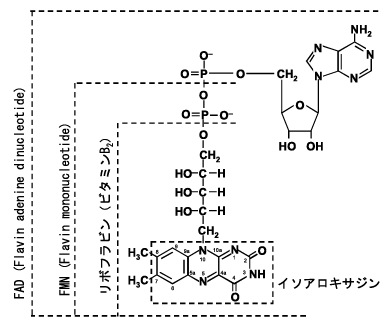
Fig. 1 フラビン分子種の構造
| Fig. 2 |
|
上述の6種類の酸化還元/イオン化状態の紫外可視吸収スペクトルはFig. 3に示すように、それぞれ際立った特徴をもっている。中性型酸化型フラビンは鮮やかな黄色を呈していて、フラビンの名前の由来となっている(flavusはラテン語の黄色である)。しかし、フラビンには、生理的に可能なこれらの6つの状態以外に、電荷移動状態という特異な電子状態があって、しばしば酵素反応に重要な役割を果たしている。電荷移動状態(charge-transfer state)とは、電子1個に相当する電荷量の一部が、電荷供与体から電荷受容体に移動して、供与体と受容体の間に相互作用が生じて複合体が形成される状態である。この複合体は電荷移動複合体(charge-transfer complex)と呼ばれる。フラビンは、電荷供与体、電荷受容体のいずれにもなり得るので、フラビンとしての電荷移動状態は、電子1個に相当する電荷量の一部を受け取った状態または、除かれた状態である。電荷移動状態にあるフラビンの吸収スペクトルは、Fig. 3とは全く異なる特徴を示す。このような様々な状態のスペクトル的特徴を利用して、フラビンの結合状態や、酵素反応を定常状態的、迅速反応的にモニターすることが可能である。また、酸化型フラビンは強い蛍光を示すことから、発光スペクトルを利用して、反応や結合状態をモニターすることも可能である。さらに、フラビンの吸収スペクトルがタンパク質のそれとはまったく重ならないことを利用して、共鳴ラマン分光の特異なプローブとしても有用である。
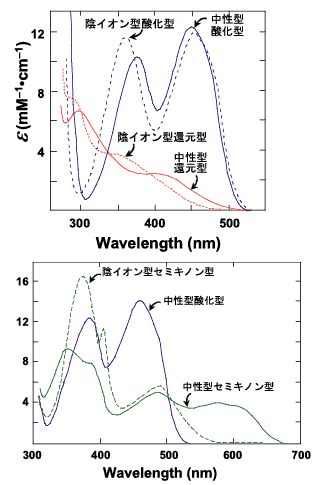
Fig. 3 フラビンの紫外可視吸収スペクトル1)
以上のように、フラビン酵素を全体としてながめると、多岐多様な基質を、多岐多様な反応に供することができるが、その基本は酸化還元反応である。酸化還元に関わるフラビン酵素の触媒サイクルは、Fig. 4に示した形式によって一般化される。基質(1)は、酵素(E)に結合した酸化型フラビン(Flox)によって酸化され生成物(1)となるが、この時、フラビンは還元型(Flred, この還元型フラビンは通常アニオン型である(Fig. 2))となる。この過程は、還元的半反応と呼ばれる。一方、還元型フラビン(Flred)は別の基質(2)によって酸化されて酸化型(Flox)にもどり、生成物(2)ができる。この過程は、酸化的半反応と呼ばれ、この過程によって酵素は最初の状態に戻り、新たな触媒サイクルに備えることができる。生体内の種々の代謝過程に関与するフラビン酵素でもっとも一般的なものが、オキシダーゼとデヒドロゲナーゼである。Fig. 4の酸化的半反応の基質(2)が酸素の場合、酵素はオキシダーゼ(フラボオキシダーゼ、すなわち、フラビンを補酵素とするオキシダーゼ)であり、それ以外の場合、通常デヒドロゲナーゼ(フラボデヒドロゲナーゼ、すなわち、フラビンを補酵素とするデヒドロゲナーゼ)と呼ばれる。
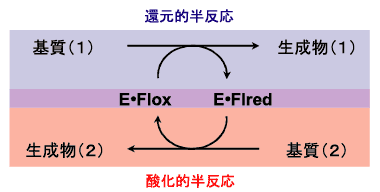
| Fig. 4 |
フラビン酵素の触媒サイクル |
ヒトを含む酸素呼吸をする動物は、燃料となる分子(たとえばグルコース)を酸素で酸化(燃焼)して、その過程で得られる自由エネルギーを利用してエネルギー通過ATPを合成している。しかし、燃料物質は決して酸素によって直接酸化されることはなく、酸素が関与するのは、ミトコンドリア電子伝達系(呼吸鎖)の末端に位置するシトクロム酸化酵素が酸素を水に還元するところであり、この呼吸鎖によって大量のATPが合成される。したがって、燃料物質が直接酸素と反応すると、ATP産生が回避され、燃料物質としての役割、すなわちATP産生という目的、が果たされなくなる。燃料物質が、エネルギー産生目的のために酸化される場合は、少しずつデヒドロゲナーゼで酸化(脱水素)されながら、その都度生じた電子が電子伝達系に供給され、ATP合成に利用される。一方、酸素を直接の酸化剤として基質を酸化する酵素反応は、ATP産生以外の目的のための酸化反応である。たとえば、特定の化合物の生合成や分解、活性酸素の生成などがこれらの目的に相当する。(ちなみに、ヒトを含む好気性動物の体内で消費される酸素の90%以上は、電子伝達系によるATP産生に使われ、それ以外の目的に使われる酸素は10%以下である。)したがって、フラビン酵素の酸化的半反応(Fig. 4)において、酸素との反応を促進するか(フラボオキシダーゼ)、抑制するか(フラボデヒドロゲナーゼ)は、酵素そのものの生理的役割と密接に関連している。以下に、酸素との反応の制御に関して、フラビン酵素がどのような分子的戦略を駆使しているかを、筆者らが得た知見を中心に解説する。
2.D-アミノ酸オキシダーゼとアシルCoAデヒドロゲナーゼ:化学的側面
D-アミノ酸オキシダーゼ(D-amino acid oxidase, DAOと略)は、D-アミノ酸を酸化的脱アミノ化する(Fig. 5)典型的なフラボオキシダーゼである。この反応で酸素が関与する過程は、還元型酵素(E・FADH-)と生成物の2-ケトイミノ酸との複合体(紫色中間状態と呼ばれる)のアニオン型還元型フラビン(FADH-:FADのフラビン部分がアニオン型還元型になっている)が酸素によって酸化されて、酸化型フラビンに戻る過程である。この過程が、DAOにおける酸化的半反応である。
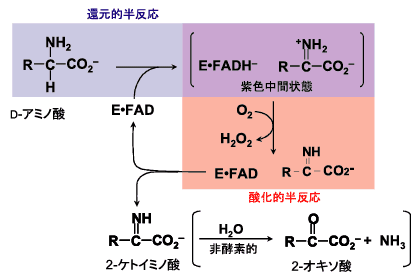
Fig. 5 D-アミノ酸オキシダーゼ(DAO)の反応
筆者らは、種々の還元型フラビン酵素と酸素の反応速度がアニオン型還元型フラビンの4a-炭素(C(4a)、フラビンの原子の番号付けは、Fig. 1を参照)の電子密度と相関することを明らかにした。この背景を理解するには、アニオン型還元型フラビンと酸素の反応(Fig. 6)とアニオン型還元型フラビンの共鳴混成(Fig. 7)の考察が必要である。すなわち、一般に還元型フラボオキシダーゼ、還元型フラボデヒドロゲナーゼの還元型フラビンはアニオン型(Fig. 2)であり、アニオン型還元型フラビンが酸素によって酸化される反応は、フラビンのC(4a)から酸素への求核攻撃によって開始される(Fig. 6)。さらに、アニオン型還元型フラビンは、Fig. 7に示す共鳴混成として存在し、負電荷はいくつかの位置に非局在化する。
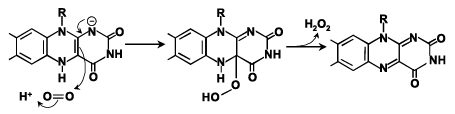
Fig. 6 酸素によるアニオン型還元型フラビンの酸化反応
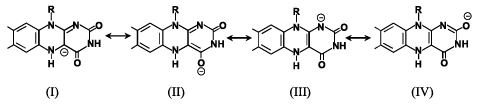
Fig. 7 アニオン型還元型フラビンの共鳴混成
筆者らが明らかにしたのは、アニオン型還元型フラビンのC(4a)の13C-NMR信号が高磁場にあるほど、酸素との反応速度定数が大きいという相関である(Fig. 8)2,3)。13C-NMR信号は、その炭素原子の電子密度に敏感であり、電子密度が高いほどその信号位置は高磁場(低い化学シフト値)に検出される。したがって、Fig. 8が意味するのは、C(4a)の電子密度が高いほど、酸素との反応性が高いということである。この結果は、アニオン型還元型フラビンと酸素の反応がC(4a)から酸素への求核攻撃によって開始される(Fig. 6)ことと緊密に対応している。
| Fig. 8 |
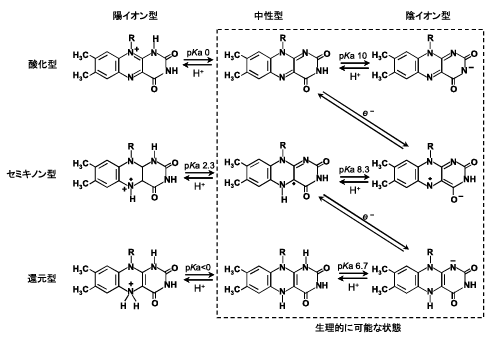
それでは、フラボオキシダーゼや、フラボデヒドロゲナーゼでは、C(4a)の電子密度がどのように調節されているのであろうか。このことを検証するために、ブタ腎臓D-アミノ酸オキシダーゼ(DAO)の紫色中間状態の結晶構造を大阪市立大学の広津建教授(当時)のグループとの共同研究によって完成させた4)。(われわれは、1996年にすでにブタDAOの酸化型の結晶構造解析を完成させている5)。)酸化型DAOの結晶に、嫌気的条件下に基質D-プロリンをソーキングすることで紫色中間状態の結晶を得ることができた。基質にD-プロリンを用いたのは、生成物のΔ1-ピロリジン-2-カルボン酸(Δ1-pyrrolidine-2-carboxylate, DPCと略)が非酵素的加水分解を受けにくく、紫色中間状態が維持されやすいからである。この紫色中間状態の結晶に、嫌気状態、低温状態(100K)でX線回折を行い、Fig. 9に示す紫色中間状態の三次構造を得ることができた4)。全体は同一構造のサブユニットからなる二量体を形成しているが、ここには単量体構造が示されている。DAOの紫色中間状態は、アニオン型還元型フラビンと対イオン型生成物DPCとの間の電荷移動相互作用によって安定化されていることが以前から知られていたが、その電荷移動相互作用の軌道間相互作用様式もFig. 9に示した。
| Fig. 9 |
|
アニオン型還元型フラビンとDPCの相互配置を詳しく調べたところ、DPCの正電荷をもつ窒素原子がアニオン型還元型フラビンのC(4a)に接近していることが判明した(Fig. 10)。すなわち、このDPCの正電荷の静電効果によってアニオン型還元型フラビンの負電荷がC(4a)に引き寄せられる。その結果、アニオン型還元型フラビンの共鳴混成を形成する極限構造のうちの(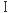 )の極限構造の寄与が高くなることが理解される。そのことによってDAOの紫色中間状態のC(4a)の電子密度が高められる。
)の極限構造の寄与が高くなることが理解される。そのことによってDAOの紫色中間状態のC(4a)の電子密度が高められる。
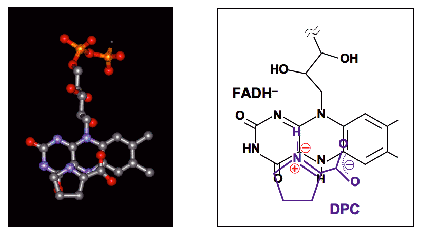
| Fig. 10 |
DAOの紫色中間状態のにおけるアニオン型還元型フラビンと生成物DPCとの相互配置4) |
このような分子戦略は、一般化されているのであろうか。そのことを検証するために、フラボデヒドロゲナーゼの紫色中間状態を調べた。アシルCoAデヒドロゲナーゼは、ミトコンドリアの脂肪酸β酸化経路の初発段階を触媒する典型的なフラボデヒドロゲナーゼで、FADを補酵素にしている。ミトコンドリアβ酸化経路は、脂肪酸をエネルギー産生に動員する代謝経路で、アシルCoAをtrans-エノイルCoAに酸化し、その時に基質から除去された電子は電子伝達系(呼吸鎖)に供給される(Fig. 11)。したがって、その酸化的半反応においては、酸素との反応は厳しく抑制されている。アシルCoAデヒドロゲナーゼは、アシル鎖の長さ・形状に対して特異性の異なる複数のメンバーから成るスーパーファミリーを構成している。その中で、特に研究の進んでいるのがアシル鎖長C6〜C12に優先的活性をもつ中鎖アシルCoAデヒドロゲナーゼ(medium-chain acyl-CoA dehydrogenase, MCADと略)である。Kimらによって明らかにされているブタ肝臓のMCADの紫色中間状態(生成物trans-エノイルCoAとアニオン型還元型フラビンとの電荷移動状態)の結晶構造解析6)に基づいて、生成物とフラビンの相互配置をFig. 12に示す。生成物のtrans-エノイルCoAのアシル部分は疎水性が高く、そこには電荷はなく、したがって、DAOの紫色中間状態に見られたような静電効果は存在しない。一方、フラビンの1-窒素(N(1))とThr136の側鎖ヒドロキシル基との間には強い水素結合が観察されている。この強い水素結合によって、アニオン型還元型フラビンの負電荷は、N(1)に優先的に局在することとなる。したがって、アニオン型還元型フラビンの共鳴混成(Fig. 7)において、極限構造( )の寄与が大きくなりC(4a)の電子密度は、DAOに比べて低くなる。その結果、MCADの紫色中間状態のアニオン型還元型フラビンと酸素の反応は抑制される。すなわち、フラボオキシダーゼでは、C(4a)に負電荷が局在する極限構造(
)の寄与が大きくなりC(4a)の電子密度は、DAOに比べて低くなる。その結果、MCADの紫色中間状態のアニオン型還元型フラビンと酸素の反応は抑制される。すなわち、フラボオキシダーゼでは、C(4a)に負電荷が局在する極限構造( )の寄与が高くなり、フラボデヒドロゲナーゼでは、C(4a)からできるだけ負電荷が遠い位置に局在する極限構造(
)の寄与が高くなり、フラボデヒドロゲナーゼでは、C(4a)からできるだけ負電荷が遠い位置に局在する極限構造( ,
, 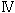 )の寄与が高くなるという、化学的には合理的な解釈が成り立つ。いいかえれば、フラボオキシダーゼとフラボデヒドロゲナーゼを選別するメカニズムとして、酸化的半反応において、アニオン型還元型フラビンの共鳴混成を構成する極限構造の寄与の分布を変動させるという精緻でかつ巧妙な分子戦略が明らかになった。
)の寄与が高くなるという、化学的には合理的な解釈が成り立つ。いいかえれば、フラボオキシダーゼとフラボデヒドロゲナーゼを選別するメカニズムとして、酸化的半反応において、アニオン型還元型フラビンの共鳴混成を構成する極限構造の寄与の分布を変動させるという精緻でかつ巧妙な分子戦略が明らかになった。
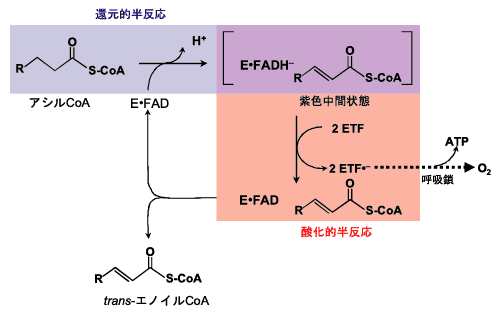
| Fig. 11 |
アシルCoAデヒドロゲナーゼの反応 |
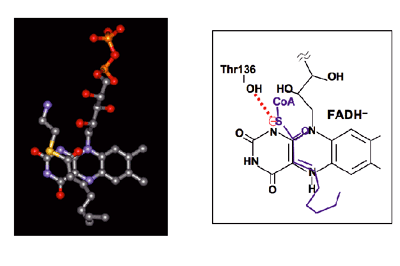
| Fig. 12 |
ブタMCADの紫色中間状態におけるアニオン型還元型フラビンと生成物trans-エノイルCoAとの相互配置6)。(左の図は、Kimらの論文6)に基づいてProtein Data Bank (PDB)に登録された原子座標を用いて再現したものである。) |
このことを、さらに確かにする実験結果がラマンスペクトルの解析からもたらされた。種々のフラボオキシダーゼとフラボデヒドロゲナーゼの紫色中間状態の共鳴ラマンスペクトルを測定して、C(4a)-C(10a)結合の伸縮振動に由来するラマン線を比較したのがFig. 13である7)。フラボオキシダーゼのラマン線が1602〜1609 cm-1の範囲に観測されるのに対して、フラボデヒドロゲナーゼでは、1612〜1620 cm-1の範囲に観測された。すなわち、Fig. 7の共鳴混成において、フラボオキシダーゼで寄与が大きいとされる(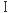 )のC(4a)-C(10a)結合次数は、フラボデヒドロゲナーゼで優先される(
)のC(4a)-C(10a)結合次数は、フラボデヒドロゲナーゼで優先される( ), (
), (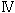 )のC(4a)-C(10a)結合次数よりも低く、その伸縮振動ラマン線は、前者で低波数側、後者で高波数側に観察されることが予想される。Fig. 13の実験結果は、このことをよく支持している。
)のC(4a)-C(10a)結合次数よりも低く、その伸縮振動ラマン線は、前者で低波数側、後者で高波数側に観察されることが予想される。Fig. 13の実験結果は、このことをよく支持している。
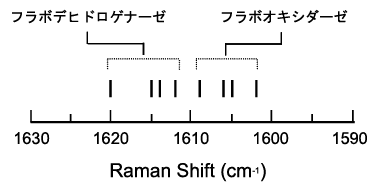
| Fig. 13 |
紫色中間状態におけるC(4a)-C(10a)伸縮振動のラマン線
(Nishina et al. の論文7)のTable |
DAOとMCADの紫色中間状態の比較で、別の興味深いことが明らかになった。これらの中間状態における生成物とフラビンの相互配置をFig. 10, 12の紙面方向から眺めたのがFig. 14である。図から明らかなように、DAOにおけるフラビン環は平面であるのに対して、MCADのそれは、N(5),N(10)のところで折れ曲がっている。Fig. 2の構造に示されるように、還元型フラビンのN(5)およびN(10)はsp3混成軌道を作っているために、通常は平面とはならず、キシレン部分とピリミジン部分の共鳴系は互いに分断される。事実、MCADの還元型フラビン環は、N(5),N(10)のところで平面性が崩れ二つの共鳴系は分断されている。ところが、DAOの紫色中間状態では、還元型フラビン環は平面性を保っていて、二つの共鳴系はN(5), N(10)の孤立電子対を仲介して互いに連続している。このために、DAOの紫色中間状態において、生成物DPCの静電効果によって、キシレン部分のπ電子までも動員が可能となって、C(4a)の電子密度上昇を増強することができる。われわれは、この場合にキシレン部分(未発表)の電子密度が低下していることを実験的に確認することができた(未発表)。
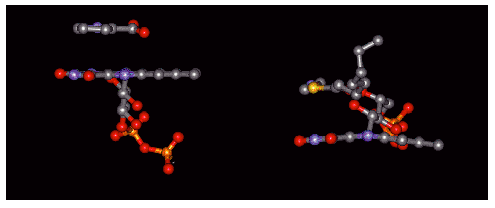
| Fig. 14 |
3.アシルCoAデヒドロゲナーゼとアシルCoAオキシダーゼ:構造的側面
前節では、フラボオキシダーゼとフラボデヒドロゲナーゼの選別のための分子戦略の化学的側面を明らかにしたが、本節では、構造的側面から同じ問題を考察する。
脂肪酸のβ酸化には、二つの経路が知られていて、一方はミトコンドリアに局在するβ酸化経路で、もう一方はペルオキシソームに局在するβ酸化経路である。前節で取り上げたMCADは前者に属し、ミトコンドリア電子伝達系(呼吸鎖)につながり、したがってエネルギー産生(ATP合成)を目的とした経路である。もう一方の、ペルオキシソームβ酸化経路は呼吸鎖には連携せず、したがってエネルギー産生とは無関係である。どちらの経路もその初発段階はアシルCoAをtrans-エノイルCoAに酸化する過程で、ミトコンドリアβ酸化系ではアシルCoAデヒドロゲナーゼ、ペルオキシソームβ酸化系ではアシルCoAオキシダーゼによって触媒される。どちらの酵素もFADを補酵素とするフラビン酵素であり、興味深いことに、両酵素群(それぞれが複数のメンバーから構成されている)は、全体として同じスーパーファミリーを形成している。名称が示すように、アシルCoAデヒドロゲナーゼは酸素を酸化剤としないのに対し、アシルCoAオキシダーゼは酸素を酸化剤とする。すなわち、酸化的半反応において、アシルCoAオキシダーゼの還元型フラビンは、酸素によって直接酸化され酸化型に戻る(Fig. 15)。Fig. 11, 15に示すように、両酵素の還元的半反応は同じであるのに対し、酸化的半反応では酸素に対する反応性が全く異なっている。しかも両酵素は、同じスーパーファミリーに属している。したがって、酸素に対する反応性制御の比較をするには、この二つは極めて適切な組み合わせである。
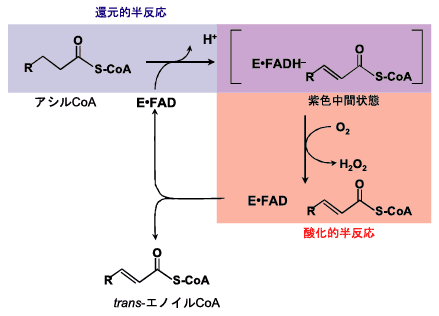
Fig. 15 アシルCoAオキシダーゼの反応
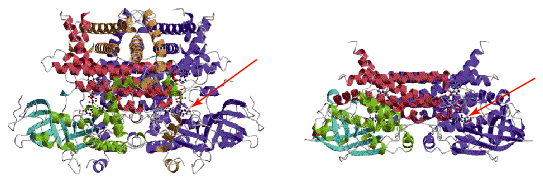
筆者らは、以上の視点から、アシルCoAオキシダーゼの結晶構造解析を大阪市立大学の広津建教授(当時)との共同研究によって行った8)。結果をFig. 16に示す。図には、比較のために中鎖アシルCoAデヒドロゲナーゼ(MCAD)の二量体構造6)も示している。ラット肝臓には基質特異性の異なる二つのアシルCoAオキシダーゼ(ACO- , ACO-
, ACO- )が存在しているが、筆者らが構造を解いたのは、そのうちのACO-
)が存在しているが、筆者らが構造を解いたのは、そのうちのACO-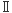 である。ACO-
である。ACO-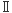 の全体構造は二量体であるのに対し、MCADは四量体構造をとるが、図には、ACO-
の全体構造は二量体であるのに対し、MCADは四量体構造をとるが、図には、ACO-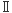 との比較のために、二量体部分を示した。MCADの四量体は、図の上部を二量体間の接触領域として、head-to-head型の四量体を形成する。このMCADの二量体間の接触領域に相当する領域は、ACO-
との比較のために、二量体部分を示した。MCADの四量体は、図の上部を二量体間の接触領域として、head-to-head型の四量体を形成する。このMCADの二量体間の接触領域に相当する領域は、ACO-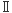 ではヘリックスの集団が覆っており、MCADのような四量体形成を不可能にしている。この図から明らかなように、MCADとACO-
ではヘリックスの集団が覆っており、MCADのような四量体形成を不可能にしている。この図から明らかなように、MCADとACO- は類似の三次構造を示しているが、二量体、四量体の違い以外に、それぞれが独自の特徴を持っている。とくに、ACO-
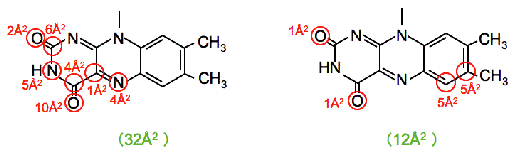
は類似の三次構造を示しているが、二量体、四量体の違い以外に、それぞれが独自の特徴を持っている。とくに、ACO- では、補酵素FADを含む活性域ポケットが広いのに比べ、MCADでは、密に詰まった状態になっている。実際フラビン環の溶媒への露出度を比較すると(Fig. 17,32Å2と12Å2)、ACO-
では、補酵素FADを含む活性域ポケットが広いのに比べ、MCADでは、密に詰まった状態になっている。実際フラビン環の溶媒への露出度を比較すると(Fig. 17,32Å2と12Å2)、ACO- の露出表面積はMCADの3倍近くあることが分かった。とくに、酸素との反応に重要な位置C(4a)はACO-
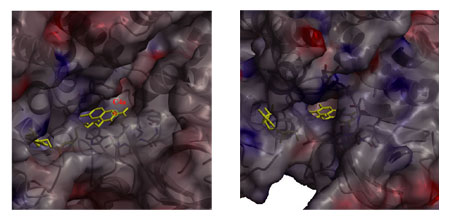
の露出表面積はMCADの3倍近くあることが分かった。とくに、酸素との反応に重要な位置C(4a)はACO- では、十分に溶媒に露出しているのに対し、MCADではタンパク質にしっかりと埋もれていて、溶媒に溶けた酸素は容易には近づくことができない構造になっている。このことは、タンパク質の外部から活性域への入り口に向かって眺めたFig. 18によって、より視覚的に確認することができる。すなわち、ACO-
では、十分に溶媒に露出しているのに対し、MCADではタンパク質にしっかりと埋もれていて、溶媒に溶けた酸素は容易には近づくことができない構造になっている。このことは、タンパク質の外部から活性域への入り口に向かって眺めたFig. 18によって、より視覚的に確認することができる。すなわち、ACO- の活性域への入り口は広く開いていて、フラビン環のC(4a)は溶媒に十分に露出している。したがって、酸化的半反応において、溶媒に溶けた酸素は容易にC(4a)に近づくことができ、酸素によるアニオン型還元型フラビンの酸化反応は容易に進行し得る。一方、MCADは、サブユニットが密に会合した四量体を形成し、しかも、フラビン環のC(4a)はタンパク質部分に埋まり込み、溶媒に溶けた酸素の接近を妨げている。
の活性域への入り口は広く開いていて、フラビン環のC(4a)は溶媒に十分に露出している。したがって、酸化的半反応において、溶媒に溶けた酸素は容易にC(4a)に近づくことができ、酸素によるアニオン型還元型フラビンの酸化反応は容易に進行し得る。一方、MCADは、サブユニットが密に会合した四量体を形成し、しかも、フラビン環のC(4a)はタンパク質部分に埋まり込み、溶媒に溶けた酸素の接近を妨げている。
| Fig. 16 |
(左)ラットアシルCoAオキシダーゼ- |
| Fig. 17 |
フラビン環の溶媒への露出表面積の比較。 |
| Fig. 18 |
活性域への入り口に向かって眺めた分子表面の比較。 |
以上のように、ACO-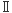 とMCADの三次構造の比較から、前者(フラボオキシダーゼ)では酸素のフラビン環、とくにC(4a)への接近が保証されているのに対し、後者(フラボデヒドロゲナーゼ)ではタンパク質によってフラビン環への酸素の接近が厳しく遮断されていることが分かった。
とMCADの三次構造の比較から、前者(フラボオキシダーゼ)では酸素のフラビン環、とくにC(4a)への接近が保証されているのに対し、後者(フラボデヒドロゲナーゼ)ではタンパク質によってフラビン環への酸素の接近が厳しく遮断されていることが分かった。
4.まとめ
フラビン酵素の酸化的半反応で、酸素が直接還元型フラビンを酸化するかどうかは、その生理的役割と密接に関連している。エネルギー産生を目的とする酵素系では、酸素との反応は厳しく阻止されなければならない。これがフラボデヒドロゲナーゼである。一方、エネルギー産生以外の生理的役割をもつフラボオキシダーゼでは、酸素との反応は促進されなければならない。そこには、アニオン型還元型フラビンの共鳴混成を変動させるという、巧妙な仕組みが潜んでいることを知ることができた。さらに、酸素との反応を物理的に促進/遮断する、構造的戦略も知ることができた。生体が進化させたこのフラボデヒドロゲナーゼとフラボオキシダーゼを選別する分子的戦略は、われわれの想像を越えた精緻で巧妙なものである。
本稿で紹介した内容は、筆者が平成20年3月まで所属していた熊本大学大学院医学薬学研究部分子酵素化学分野において行われた研究成果に基づいたものである。当時、それに参画していただいた諸氏のお名前を以下に記し、深く感謝申し上げます。瀬戸山千秋准教授、玉置治彦助教、二科安三准教授(現医学部教授)、志賀潔教授(以上熊本大学(当時))、広津研教授、宮原郁子准教授、水谷尚志博士、中嶋義隆博士、(以上大阪市立大学(当時))。
| 著者プロフィール | |
| 氏名 | 三浦 洌(Retsu Miura) |
| 所属 | 株式会社同仁化学研究所 顧問 |
| 住所 | 熊本県上益城郡益城町田原2025-5 |
| Copyright(c) 1996-2008 DOJINDO LABORATORIES,ALL Rights Reserved. |

 を図にした)
を図にした)