機能性キレート試薬
蛋白質を固体表面に並べるための“His-tag”と呼ばれる技術が最近注目されている。今回製品化した AB-NTA は、1987年 Hochuli1)らによって報告されたもので、この His-tag 技術にとって最も欠かせない 基本的なツールになっている。もともとこの技術は、分子生物学の分野で(遺伝子組換え技術によって発現させた)人工蛋白質の精製に最も威力を発揮してきたが2)、現在では、ガラス基板や金電極といった固体表面に、蛋白質を一定の配向性で結合させる目的に用いられるようになってきた。
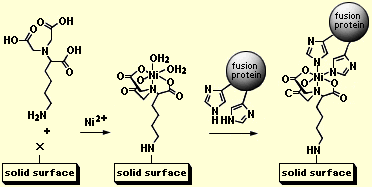
基本原理を上記のスキームに示している。His-tag 技術により、複雑な高次構造を持つ蛋白質を、その活性を損なわずに固体表面に化学的に結合させることが可能になった。まず、AB-NTA を官能化された(通常、サクシニミド、SH、エポキシなどの反応性基を持った)固体表面と反応させ、さらに、Ni (II) を加え錯形成させる。ここで、Ni (II) の配位座は AB-NTA によって完全には満たされず、空いた部分には水が配位している。この状態で、6個のヒスチジンを末端に発現させた融合蛋白質を加えると、ヒスチジン部分が Ni (II) に配位するため、特異的かつ一定方向に固体表面に結合されることになる(この結合は強固だが、フリーのヒスチジンやイミダゾール,EDTA等のキレート剤によって可逆的に解離する)。
図1は、この試薬を用いて green fluorescent protein(His6-GFP)をポリスチレンビーズに結合させ、蛍光顕微鏡で観察した例である。さらにこの His-tag 技術の一般的応用として、固体表面に生体機能を再現させることが可能であり、実際、バイオセンサーへの応用も盛んに研究されている。特に、生体分子の検出や相互作用の解析に有用な表面プラズモン共鳴(SPR)では、キーテクノロジーとなりつつある3,4)。また、蛋白質の構造解析法としても注目されている5)。これは、基板上に蛋白質単分子膜をつくり蛍光X線干渉を測定するもので、結晶化しない蛋白質でも生理的条件下でその構造についての情報を得ることができる。
最後に、His-tag 技術による最近の一分子蛍光観察の例を紹介する。野地らは6)、ATP 合成酵素の F1 部分を Ni (II) を介してガラス基板上に固定し、ATP の加水分解に伴ってγサブユニットが回転する様子を捉えることに成功し、従来から提唱されてきた回転触媒説を実証した。ここでも、直接“見る”ことの重要性、また、そのために His-tag 技術が不可欠であることを教えている。
参考文献
1) E. Hochuli, H. Doeli, A. Schacher, J. Chromatogr., 411, 177.(1987).
2) E. Hochuli, J. Chromatogr., 1988, 444, 293(1988).
3) G. B. Sigal, C. Bamdad, A. Barberis, J. Strominger, G. M. Whitesides, Anal. Chem, 68, 490(1996).
4) E. L. Schmid, T. A. Keller, Z. Dienes, H. Vogel, Anal. Chem., 69, 1979 (1997).
5) Y. C. Sasaki, Y. Suzuki, T. Ishibashi, Science, 263, 62(1994).
6) H. Noji, R. Yasuda, M. Yoshida, K. Kinosita, Jr., Nature, 386, 299 (1987).
|
コード番号
|
品名
|
容量
|
価格(¥)
|
|
|
AB-NTA
|
100mg
|
9,600
|
